
| A. | 2-丁醇 | B. | 2-甲基-2丙醇 | C. | 甲醇 | D. | 2-甲基-2-丁醇 |
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的醋酸溶液的c(H+)约为0.01 mol•L-1 | |
| B. | 醋酸能与NaHCO3溶液反应放出CO2 | |
| C. | 醋酸的导电性比盐酸溶液的弱 | |
| D. | 10 mL 1 mol•L-1醋酸恰好与10 mL1 mol•L-1NaOH溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
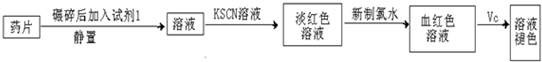

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:选择题
某气体的摩尔质量为Mg/mol,NA表示阿伏加德罗常数的值,在一定的温度和压强下,体积为VL的该气体所含有的分子数为X,则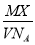 表示的是
表示的是
A、VL该气体的质量(以g为单位)
B、1L该气体的质量(以g为单位)
C、1mol该气体的体积(以L为单位)
D、1L该气体中所含的分子数
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
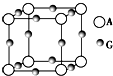 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com