


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.铜矿较易还原,铝矿很难还原? |
| B.铜矿颜色较深,易发现;铝矿颜色较浅,不易发现? |
| C.矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发? |
| D.铜比铝相对原子质量大 |
查看答案和解析>>
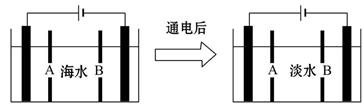
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阴极产物为H2 | B.阳极先析出Cl2,后析出O2 |
| C.电解液的pH不断增大,最终大于7 | D.整个电解的过程实质是电解水 |
查看答案和解析>>
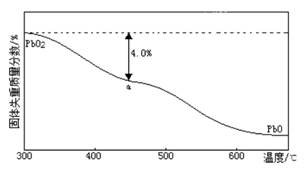
科目:高中化学 来源:不详 题型:实验题
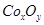 ,并测定其化学式。
,并测定其化学式。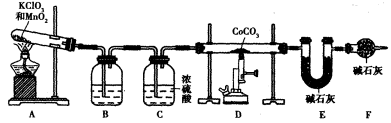
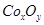 后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成物
后,若称得E管增重4.40g,D管内残留物质的质量是8.30g,则生成物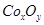 的化学式为____________。
的化学式为____________。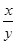 的值______(填“偏大”、“偏小”或“无影响”)。
的值______(填“偏大”、“偏小”或“无影响”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
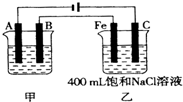
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.随着电解的进行,c(NaCl)降低,需不断补充饱和食盐水 |
| B.电解过程中采用增大阳极区溶液pH的方法,可以减少Cl2在水中的溶解量 |
| C.阳离子交换膜的作用是阻止OH-移向阳极,以使氢氧化钠在阴极区富集 |
| D.阳极表面用钛氧化物涂层处理,目的是降低电解产物Cl2对电极的腐蚀 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
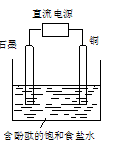
| A.铜电极附近观察到黄绿色气体 |
| B.石墨电极附近溶液呈红色 |
| C.溶液中的Na+向石墨电极移动 |
| D.铜电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
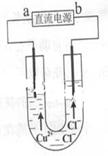
| A.a端是直流电源的负极 |
| B.通电使CuCl2发生电离 |
| C.阳极上发生的反应:Cu2++2e-=Cu |
| D.通电一段时间后,在阴极附近观察到黄绿色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com