
| A. | 当 pH=7 时,若 V1=V2,则一定是 c2>c1 | |
| B. | 在任何情况下都满足 c(Na+ )+c(H+ )=c(CH3COO- )+c(OH- ) | |
| C. | 若 pH>7,则一定是 c1V1>c2V2 | |
| D. | 若 V1=V2,c1=c2,则 c(CH3COO-)+c(CH3COOH)=c(Na+) |
分析 A.醋酸钠是强碱弱酸盐,其水溶液呈碱性,若要使其呈中性,酸应该稍微过量;
B.溶液呈电中性,溶液中阴阳离子所带电荷相等;
C.当溶液呈碱性时,溶液中氢离子浓度小于氢氧根离子浓度,但混合时醋酸的物质的量不一定等于氢氧化钠的物质的量
D.当醋酸和氢氧化钠的物质的量相等时,根据物料守恒确定醋酸根离子和醋酸分子浓度与钠离子浓度的关系.
解答 解:A.醋酸钠是强碱弱酸盐,其水溶液呈碱性,若要使混合溶液呈中性,酸应该稍微过量,所以当pH=7时,若v1=v2,则一定是c2>c1,故A不选;
B.溶液呈电中性,溶液中阴阳离子所带电荷相等,所以得c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故B不选;
C.醋酸是弱酸,氢氧化钠是强碱,所以等物质的量的酸和碱混合时,溶液呈碱性,当氢氧化钠过量时溶液更呈碱性,所以当PH>7时,则一定是c1v1≥c2v2,故C选;
D.如果V1=V2、c1=c2,则醋酸和氢氧化钠的物质的量相等,混合后恰好反应生成醋酸钠,根据溶液中物料守恒得c(CH3COO-)+c(CH3COOH)=c(Na+),故D不选;
故选C.
点评 本题考查了酸碱混合溶液的定性判断,题目难度中等,根据溶液中物料守恒和电荷守恒即可解答本题,该知识点是学习的难点,也是考试的热点,试题有利于提高学生的分析能力及灵活应用能力.


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物与人们的衣、食、住、行及健康等有非常密切的关系,认知和研究有机物具有十分重要的作用.
有机物与人们的衣、食、住、行及健康等有非常密切的关系,认知和研究有机物具有十分重要的作用.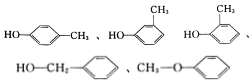 (任写一种).
(任写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结 论 | |
| ① | SO2使酸性高锰酸钾溶液褪色 | 可证SO2有漂白性 |
| ② | 用磨口玻璃瓶保存NaOH溶液,用热的纯碱溶液淸洗容器里附有的油污 | 都发生了氧化还原反应 |
| ③ | 取少量Na2SO3样品加入Ba(NO3)2溶液后,产生白色沉淀,滴加稀盐酸,沉淀不溶解 | 证明Na2SO3已氧化变质 |
| ④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀'生成 | 确定该溶液存在CO32- |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体使湿润红色石蕊试纸变蓝 | 该溶液一定有NH4+ |
| A. | ①② | B. | ③④⑤ | C. | ②④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | CCl4起到萃取、富集I2的作用 | |
| B. | a中下层变无色,说明I2 转化为I- | |
| C. | Ⅲ中发生反应的离子方程式为:Br2+2I-═I2+2Br- | |
| D. | 只依据a、b中现象,不可以证明Cl2的氧化性比 Br2强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com