
 有机物与人们的衣、食、住、行及健康等有非常密切的关系,认知和研究有机物具有十分重要的作用.
有机物与人们的衣、食、住、行及健康等有非常密切的关系,认知和研究有机物具有十分重要的作用.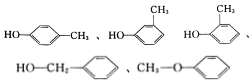 (任写一种).
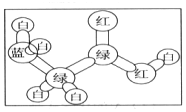
(任写一种). 分析 (1)根据原子成键特点知,蓝色球表示N原子、绿色球表示C原子、白色球表示H原子、红色球表示O原子,所以该分子结构简式为NH2CH2COOH,根据结构简式确定分子式及官能团;
(2)该有机物完全燃烧后生成二氧化碳和水,氯化钙吸收的是水蒸气,然后碱石灰吸收的是二氧化碳,根据A管质量知,m(H2O)=2.16g,则n(H)=$\frac{2.16g}{18g/mol}$×2=0.24mol,B管质量中m(CO2)=9.24g,n(C)=$\frac{9.24g}{44g/mol}$×1=0.21mol,n(O)=$\frac{3.24g-0.24mol×1g/mol-0.21mol×12g/mol}{16g/mol}$=0.03mol,
有机物的物质的量=$\frac{3.24g}{108g/mol}$=0.03mol,所以该有机物中C、H、O原子个数分别为$\frac{0.21mol}{0.03mol}$=7、$\frac{0.24mol}{0.03mol}$=8、$\frac{0.03mol}{0.03mol}$=1,该分子式为C7H8O;
该分子不饱和度=$\frac{7×2+2-8}{2}$=4,苯环的不饱和度是4,所以该分子中除了含有苯环外不含有双键、三键,因为含有一个O原子,所以存在的官能团可能是-OH或-O-.
解答 解:(1)根据原子成键特点知,蓝色球表示N原子、绿色球表示C原子、白色球表示H原子、红色球表示O原子,所以该分子结构简式为NH2CH2COOH,根据结构简式确定分子式为C2H5O2N,含氧官能团名称为羧基,
故答案为:C2H5O2N;羧基;
(2)该有机物完全燃烧后生成二氧化碳和水,氯化钙吸收的是水蒸气,然后碱石灰吸收的是二氧化碳,根据A管质量知,m(H2O)=2.16g,则n(H)=$\frac{2.16g}{18g/mol}$×2=0.24mol,B管质量中m(CO2)=9.24g,n(C)=$\frac{9.24g}{44g/mol}$×1=0.21mol,n(O)=$\frac{3.24g-0.24mol×1g/mol-0.21mol×12g/mol}{16g/mol}$=0.03mol,
有机物的物质的量=$\frac{3.24g}{108g/mol}$=0.03mol,所以该有机物中C、H、O原子个数分别为$\frac{0.21mol}{0.03mol}$=7、$\frac{0.24mol}{0.03mol}$=8、$\frac{0.03mol}{0.03mol}$=1,该分子式为C7H8O;
该分子不饱和度=$\frac{7×2+2-8}{2}$=4,苯环的不饱和度是4,所以该分子中除了含有苯环外不含有双键、三键,因为含有一个O原子,所以存在的官能团可能是-OH或-O-,则其同分异构体为 (任写一种),
(任写一种),
故答案为:C7H8O; (任写一种).
(任写一种).
点评 本题考查有机物分子式确定、同分异构体结构简式书写等知识点,侧重考查学生分析判断、计算能力,难点是同分异构体的书写,注意书写同分异构体时按一定顺序,防止重写或漏写,题目难度中等.


科目:高中化学 来源: 题型:解答题
 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.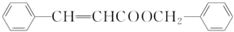 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 分离方法 |
| A | 除去铜器表面的铜绿【Cu2(OH)2CO3】 | 用盐酸浸泡,用清水冲洗 |
| B | 除去乙醇中的少量水 | 加生石灰,再蒸馏 |
| C | 除去 HCl中的 C12 | 通过饱和食盐水洗气再干燥 |
| D | 除去NaCl固 体中的 NH4Cl | 加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 (1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:
(1)将煤转化为水煤气是通过化学方法将煤转化为洁净燃料的方法之一.已知C(s)、CO(g)和H2(g)完全燃烧的热化学方程式分别为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| A | 78 | 0.8786 | 80 | A,B,C互溶 |
| B | 74 | 0.81018 | 108 | |
| C | 130 | 0.8670 | 142 |
| A. | 不能用蒸馏的方法进行分离 | |
| B. | 可以用过滤的方法进行分离 | |
| C. | 若采用蒸馏操作,冷凝管中冷却水的流向应该与蒸气的流向相反 | |
| D. | 该实验中用到的玻璃仪器有:酒精灯、蒸溜烧瓶、冷凝管、接液管、锥形瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当 pH=7 时,若 V1=V2,则一定是 c2>c1 | |
| B. | 在任何情况下都满足 c(Na+ )+c(H+ )=c(CH3COO- )+c(OH- ) | |
| C. | 若 pH>7,则一定是 c1V1>c2V2 | |
| D. | 若 V1=V2,c1=c2,则 c(CH3COO-)+c(CH3COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
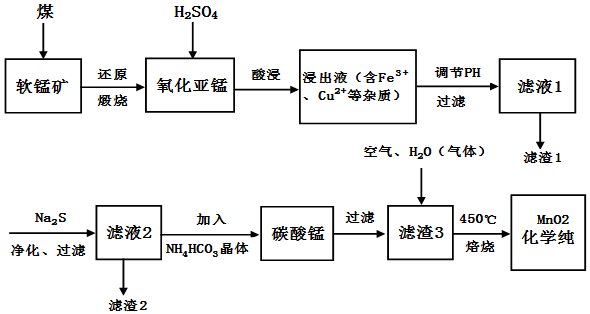
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com