
(1)选择题
①二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中不能对二者进行鉴别的是 ( )
A.利用金属钠或者金属钾
B.利用质谱法
C.利用红外光谱法
D.利用核磁共振氢谱
②下列化合物的1H-NMR谱图中吸收峰数目正确的是( )

③手性分子是指在分子结构中![]() ,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不属于手性碳原子的是( )
![]() A.苹果酸
A.苹果酸
B.丙氨酸
C.葡萄糖
 |
D.甘油醛
(2)仅由碳、氢、氧三种元素组成的有机化合物,经测定其相对分子质量为46,取该有机化合物样品4.6g,在纯氧中完全燃烧,将产物先后通过浓硫酸和碱石灰,两者分别增重5.4g和8.8g。
①求该有机化合物的分子式。
②若该有机化合物的1H核磁共振谱如下图所示,请写出该有机化合物的结构简式。

科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 ClO(g)+3H2(g)△H>0.
ClO(g)+3H2(g)△H>0. CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| V2 |
| a2 |
| V2 |
| a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
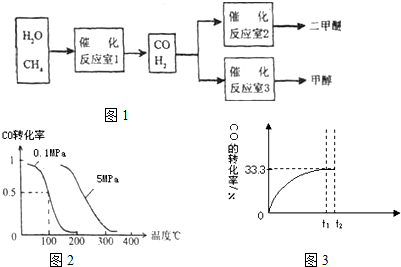
 二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:| c(CH3OCH3)?c(CO2) |
| c3(CO)?c3(H2) |
| c(CH3OCH3)?c(CO2) |
| c3(CO)?c3(H2) |
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com