
【题目】提出元素周期律并根据周期律编制第一个元素周期表的科学家是
A. 道尔顿 B. 牛顿 C. 门捷列夫 D. 阿佛加德罗
科目:高中化学 来源: 题型:
【题目】不可用于比较F和Cl非金属性的是( )
A.溶液pH值:NaF>NaCl
B.共价键极性:C-F>C-Cl
C.单质氧化性:F2>Cl2
D.氢化物稳定性:HF>HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】干电池原理示意图如图所示,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是

A. 常见锌锰干电池为二次电池
B. 碳为电池的正极
C. Zn极上发生还原反应
D. 反应2NH4++2e-=2NH3↑+H2↑在负极上发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞中化学元素的叙述,正确的是
A. 细胞中一种元素的作用能被其他元素替代
B. 细胞中的脱氧核苷酸和脂肪酸都不含有氮元素
C. 主动运输机制有助于维持细胞内元素组成的相对稳定
D. 细胞中的微量元素因含量极少而不如大量元素重要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,NH3和H2S气体的密度比是;同质量的NH3和H2S气体的体积比是;同温同密度同体积的NH3和H2S气体中所含H个数比是;若两者所含H个数相等,它们的物质的量之比是;同温同体积下,同质量的NH3和H2S气体的压强之比是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有下列离子的溶液中滴加NaCl并通入足量SO2气体后,溶液中还可能大量共存的离子组是( )
A.NH4+、H+、NO3-B.H+、Fe2+、SO42-
C.Ag+、Fe3+、SO42-D.Fe3+、Ba2+、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或叙述正确的是
A. 1 mol液态肼在足量氧气中完全燃烧生成水蒸气,放出642 kJ的热量:N2H4(l)+O2(g) ===N2(g)+2H2O(g) ΔH=+642 kJ·mol-1
B. 12 g石墨转化为CO时,放出110.5 kJ的热量:2C(石墨,s)+O2(g) ===2CO(g) ΔH=-110.5 kJ·mol-1
C. 已知:H2(g)+ ![]() O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
O2(g) ===H2O(l) ΔH=-286 kJ·mol-1,则:2H2O(l) ===2H2(g)+O2(g)的ΔH=+572 kJ·mol-1
D. 已知N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下向密闭容器中充入0.5 mol N2(g)和1.5 mol H2(g)充分反应放出46.2 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
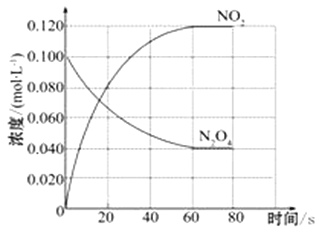
回答下列问题:
(1)反应的△H___________0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如上图所示。在0~60s时段,反应速率v(N2O4)为_____________molL-1s-1,反应的平衡常数K1为______________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 molL-1s-1的平均速率降低,经10 s又达到平衡。
① T __________100℃(填“大于”“小于”),判断理由是______________________________________;
② 温度T时反应的平衡常数K2 为 ___________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______________(填“正反应”或“逆反应”)方向移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com