
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O)晶体,设计了如下流程:

已知:(1)常温下,金属离子开始沉淀和沉淀完全时的pH 见下表。
开始形成氢氧化物沉淀的pH | 完全形成氢氧化物沉淀的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Al3+ | 3.3 | 5.0 |
(2)七水合硫酸亚铁(FeSO4·7H2O)的溶解度
温度/℃ | 10 | 20 | 30 | 40 | 50 |
FeSO4·7H2O溶解度(g) | 15.5 | 26.5 | 32.9 | 40.2 | 48.9 |
(1)溶解烧渣选用足量硫酸,写出Fe2O3与硫酸反应的离子方程式_______________;检验溶液1中含有Fe3+的实验方法是___________________;
(2)固体1是制作单晶硅的主要原料,写出该反应的化学方程式___________________;
(3)试剂X是__________________;固体2是___________________;
(4)加入NaOH溶液控制pH应不超过_________________;
(5)从溶液2中获得晶体的的方法为______________, _____________过滤、洗涤、干燥。
【答案】Fe2O3+ 6H+=2Fe3+ +3H2O取原溶液适量于洁净的小试管中,滴加KSCN溶液,若溶液显红色,则原溶液中含有Fe3+SiO2+C ![]() Si+COFeAl(OH)37.0高温溶解冷却结晶
Si+COFeAl(OH)37.0高温溶解冷却结晶
【解析】
烧渣的主要成分为Fe2O3、SiO2、Al2O3,烧渣中加入足量酸,其中Fe2O3、Al2O3转化为Fe3+、Al3+进入溶液1中,SiO2与酸不反应,固体1的成分为SiO2;根据流程,从溶液2中能获得FeSO4·7H2O,溶液2中溶质含FeSO4,则试剂X具有还原性,能将Fe3+还原为Fe2+,且不引进新杂质,则试剂X为Fe;根据各金属离子开始沉淀和沉淀完全时的pH,加入NaOH溶液控制pH使Al3+全部转化为Al(OH)3沉淀而除去、Fe2+不形成沉淀,控制的pH范围在5.0~7.0之间;FeSO4·7H2O受热易分解,FeSO4·7H2O的溶解度随着温度的升高明显增大,所以从溶液2中获得FeSO4·7H2O的操作为:蒸发浓缩、冷却结晶,过滤、洗涤、干燥;据此作答。
烧渣的主要成分为Fe2O3、SiO2、Al2O3,烧渣中加入足量酸,其中Fe2O3、Al2O3转化为Fe3+、Al3+进入溶液1中,SiO2与酸不反应,固体1的成分为SiO2;根据流程,从溶液2中能获得FeSO4·7H2O,溶液2中溶质含FeSO4,则试剂X具有还原性,能将Fe3+还原为Fe2+,且不引进新杂质,则试剂X为Fe;根据各金属离子开始沉淀和沉淀完全时的pH,加入NaOH溶液控制pH使Al3+全部转化为Al(OH)3沉淀而除去、Fe2+不形成沉淀,控制的pH范围在5.0~7.0之间。
(1)Fe2O3与硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,离子方程式为Fe2O3+6H+=2Fe3++3H2O。检验Fe3+用KSCN溶液,检验溶液1中含Fe3+的实验方法是:取溶液1适量于洁净的小试管中,滴加KSCN溶液,若溶液显红色,则溶液1中含有Fe3+。
(2)固体1的成分为SiO2,SiO2制作Si的化学方程式为SiO2+2C![]() Si+2CO↑。
Si+2CO↑。
(3)试剂X的作用是将Fe3+还原为Fe2+,且不引进新杂质,试剂X为Fe,加入Fe发生的主要反应的离子方程式为Fe+2Fe3+=3Fe2+。根据各金属离子开始沉淀和沉淀完全时的pH,加入NaOH溶液控制pH使Al3+全部转化为Al(OH)3沉淀而除去、Fe2+不形成沉淀,固体2是Al(OH)3。
(4)根据各金属离子开始沉淀和沉淀完全时的pH,加入NaOH溶液控制pH使Al3+全部转化为Al(OH)3沉淀而除去、Fe2+不形成沉淀,控制pH应不超过7.0。
(5)由于FeSO4·7H2O受热易分解,FeSO4·7H2O的溶解度随着温度的升高明显增大,所以从溶液2中获得FeSO4·7H2O的操作为:蒸发浓缩、冷却结晶,过滤、洗涤、干燥。


科目:高中化学 来源: 题型:
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:________________;(填编号)
(2)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是_________________,稀释后,HX溶液中水电离出来的c(H+)_______醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:_______________________;
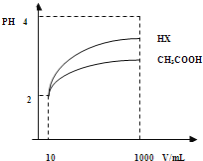
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=____________________.(填准确数值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.目前已确认人体内必需元素(生命元素)共有27种
B.我们可以通过调节日常饮食来补充必需元素
C.大量服用补铁剂可以使血红蛋白输送氧气的能力提高
D.油脂是维持人体生命活动不可缺少的一类物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中数据,推测磷元素的原子半径可能是( )
元素 | N | S | O | Si |
原子半径/(10-10m) | 0.75 | 1.02 | 0.73 | 1.11 |
A.0.80×10-10mB.1.10×10-10m
C.1.20×10-10mD.0.70×10-10m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)一定条件下,SO2与O2反应10 min后,若SO2和SO3物质的量浓度分别为0.1 mol/L和0.3 mol/L,则10 min内生成SO3的化学反应速率为___________;SO2的转化率为___________。
(2)下列关于该反应的说法正确的是_________。
A.增加O2的浓度能加快反应速率 B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率 D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中若某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是______。
A.O2为0.2 mol/L B.SO2为0.25 mol/L
C.SO3为0.4 mol/L D.SO2、SO3均为0.15 mol/L
(4)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的化学方程式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com