
����Ŀ��ij�л����A��Ϊͬ���칹�壬���ⶨ���ǵ���Է�������С��100����1mol����O2�г��ȼ�յõ������ʵ�����CO2��H2O (g) ��ͬʱ����112L O2����״�����������������½�1mol����ȫˮ���������1mol�Һ�1mol����������һ�������£������Ա�����������Ϊ�ҡ�
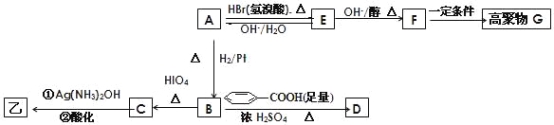
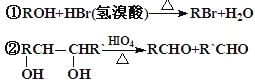
��������ײⶨ���ڼ�A�Ľṹ�ж�����C=O˫����C-O������B��HIO4���ڲ�����ʱֻ����һ�ֲ���C������Ϊ����ط�Ӧ����Ϣ��ת����ϵ��
�� ��ȷ����д���ķ���ʽ_______�������ͬ�����ʵ�ͬ���칹�干��____�֣������ף���
�� E��F �ķ�Ӧ����Ϊ_________��Ӧ��
�� A�Ľṹ��ʽΪ_________��G �Ľṹ��ʽΪ_________��
�� B��D�ķ�Ӧ��ѧ����ʽΪ_______________________________��
�� д��C���������½��з�Ӧ�Ļ�ѧ����ʽ___________________��
���𰸡�C4H8O2 4 ��ȥ��Ӧ ![]()
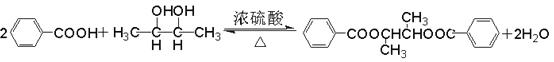
![]()
��������
�����������£�1mol����ȫˮ��Ϊ1mol�Һ�1mol�����ұ����Ա�����Ϊ�ң����Ϊ������Ϊ���ᣬ��Ϊ�������ҡ�����̼ԭ�Ӹ�����ͬ���Ȼ����ǻ��ĸ���Ҳ��ͬ������1mol����O2�г��ȼ�յõ������ʵ�����CO2��H2O�����ڼ����У�C��H�ĸ�����Ϊ1��2�����ΪһԪ����������ΪһԪ�������ᣬ��ΪһԪ���ʹ�������1mol����ȫȼ�գ�����5molO2��![]() =5mol������ķ���ʽΪCnH2nO2����ȼ�շ�ӦΪ��
=5mol������ķ���ʽΪCnH2nO2����ȼ�շ�ӦΪ��![]() ������
������![]() �����n=4����ķ���ʽΪC4H8O2��������Ϊ98��С��100�������Ϊ����������CH3COOCH2CH3����Ϊ����CH3COOH����Ϊ�Ҵ�CH3CH2OH��CΪCH3CHO��B��HIO4��Ӧ����C����BΪ
�����n=4����ķ���ʽΪC4H8O2��������Ϊ98��С��100�������Ϊ����������CH3COOCH2CH3����Ϊ����CH3COOH����Ϊ�Ҵ�CH3CH2OH��CΪCH3CHO��B��HIO4��Ӧ����C����BΪ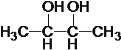 ��A��H2��Ӧ����B����A�ͼ�Ϊͬ���칹�壬A�к���C=O˫����C-O��������AΪ
��A��H2��Ӧ����B����A�ͼ�Ϊͬ���칹�壬A�к���C=O˫����C-O��������AΪ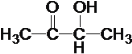 �����ݷ�Ӧ�٣������Ƴ�EΪ
�����ݷ�Ӧ�٣������Ƴ�EΪ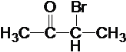 ��FΪ
��FΪ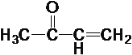 ��GΪ
��GΪ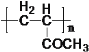 ��DΪ
��DΪ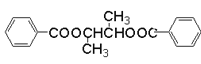 ��(1)����������Ϊ���������������ʽΪC4H8O2����ͬ�����ʵ�ͬ���칹���м�����������������������������������������£�����4��ͬ���칹�壻
��(1)����������Ϊ���������������ʽΪC4H8O2����ͬ�����ʵ�ͬ���칹���м�����������������������������������������£�����4��ͬ���칹�壻
(2) EΪ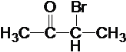 ��FΪ
��FΪ ����E��F�ķ�Ӧ����Ϊ��ȥ��Ӧ��
����E��F�ķ�Ӧ����Ϊ��ȥ��Ӧ��
(3) A�Ľṹ��ʽΪ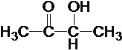 ��G�Ľṹ��ʽΪ
��G�Ľṹ��ʽΪ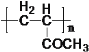 ��
��
(4) BΪ ��DΪ
��DΪ ����B��D�Ļ�ѧ����ʽΪ
����B��D�Ļ�ѧ����ʽΪ ��
��
(5)CΪCH3CHO����������Ӧ�ķ���ʽΪ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ���Ҫ���ڴ��������Ʒ�ˮʱ���綾��CN-�����ڴ���TiO2���������£�����NaClO��CN-����������CNO-��CN-��CNO-��NԪ�ؾ�Ϊ-3�ۣ����������������¼�����NaClO��Ӧ����N2��CO2��Cl2������������Ա���ܱ�ϵͳ������ͼװ�ý���ʵ�飬�ⶨCN-�������İٷ��ʡ�

�ֽ�Ũ����CN-���ӵ���ˮ�����NaClO��Һ�Ļ��Һ������У�������Ƥ����һ��ʱ�����Ƥ���ͻ�����ʹ��Һȫ���������У��رջ������ش��������⣺
��1���������⣬д�������Ҫ��Ӧ�����ӷ���ʽ�����еķ�Ӧ_________________�����еķ�Ӧ��_____________________��
��2������ʵ����ͨ���ⶨCO2������ȷ����CN-�Ĵ���Ч������װ���е��Լ���______________����װ�õ�Ŀ����________________________������ܢ��������______________________��
��3���ٶ�����ÿһ��װ�ö�������գ������ø�װ�ò�õ�CN-�������İٷ�����ʵ��ֵ���_____���ƫ�ߡ���ƫ�͡������������ܵ�ԭ��______________________��
��4�������ˮҲ�ɲ��õ绯ѧ�������д������ڼ��������£�ʹ�ö��Ե缫��⺬���ˮ�������ӱ�����Ϊ�������ʣ����������缫��Ӧʽ��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������H�������������㡢���������ζ�����������־ã����㷺�����㾫��ϡ�ͼ��Ͷ�������ϳɸû������ij��;����ͼ��ʾ��
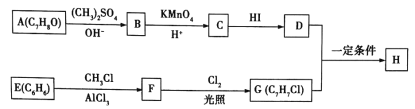
��֪������Ϣ��
��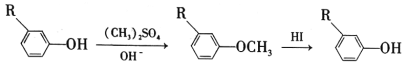 ��
��
��A�ı����������ֻ�ѧ������ͬ����ԭ�ӣ���ȡ������λ�����ڣ�
����D�еμӼ���FeCl3��Һ��������Ӧ�Գ���ɫ��
�ܷ�����F����Է�����������90��100֮�䣬0.1molF���ȼ�տ�����7.2gˮ��
��R1COOH+RCH2C1![]() R1COOCH2R+HCl��
R1COOCH2R+HCl��
�ش��������⣺
(1)A�Ļ�ѧ������___________����C����D�ķ�Ӧ�Ļ�ѧ����ʽΪ_______________��
(2)��F����G�ķ�Ӧ�Ļ�ѧ����ʽΪ____________________����Ӧ����Ϊ________________��
(3)H�Ľṹ��ʽΪ__________________��
(4)������������ȡ����������������A�������Ĺ�������ͬ��ͬʱ���ܷ���������Ӧ��C��ͬ���칹����___________(�����������칹)�֣����������5�ֻ�ѧ������ͬ����ԭ�ӣ�����ԭ�Ӹ���֮��Ϊ1��2��2��2��1��ͬ���칹��Ľṹ��ʽ��_____________(��дһ�ּ���)��
(5)���Ӿ���ͼ��ʾ����ɺϳɻ�����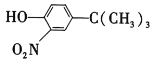 ��
��
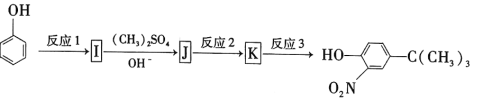
��Ӧ1���õ��Լ�Ϊ____________��K�Ľṹ��ʽΪ___________����Ӧ3���õ��Լ�Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������һ�����Ϳɳ���أ�����ͨ���ܵ����ȣ��õ�س�ʱ�䱣���ȶ��ķŵ��ѹ��������ص��ܷ�ӦʽΪ��
3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
������������ȷ����
A. �ŵ�ʱ�����ķ�ӦΪ��Zn-2e-+2OH-![]() Zn(OH)2
Zn(OH)2
B. ���ʱ������ӦΪ��Fe(OH)3-3e-+5OH-![]() FeO42-+4H2O
FeO42-+4H2O
C. �ŵ�ʱÿת��3 mol���ӣ�������1 mol K2FeO4����ԭ
D. �ŵ�ʱ����������Һ�ļ��Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������л������NaOH����H2SO4����CH3COOH����NaCl����CH3COONa����NH4Cl����CH3COONH4����NH4H2SO4����NH3��H2O����ش��������⣺
��1����Ũ�Ⱦ�Ϊ0.1mol��L-1���������NaOH��NH3��H2O�ֱ��ˮϡ��m����n����
ϡ�ͺ�������Һ��pH�����9����m_______n ������>������<������=������
��2����֪ˮ��������ƽ�⣺H2O+H2O![]() H3O��+OH����H>0������ʹƽ�������ƶ�����������Һ�����ԣ�ѡ������з�����_______��
H3O��+OH����H>0������ʹƽ�������ƶ�����������Һ�����ԣ�ѡ������з�����_______��
A����ˮ�м���NaHSO4���� B����ˮ�м�NaHCO3����
C��������100�� [����c (H��) =1��10��6 mol��L-1] D����ˮ�м���NH4Cl����
��3�������£�pH=11��CH3COONa��Һ�У�ˮ���������c(OH��)=_______����pH=3��CH3COOH��Һ�У�ˮ���������c(H��)=_______��
��4��NH4Cl��Һ������Ũ�ȴ�С˳��Ϊ______________��
��5�����ʵ���Ũ����ͬ��������������������ϡ��Һ�У�NH4+Ũ���ɴ�С��˳���ǣ�����ţ�_______��
��6����֪t��ʱ��Kw=1��10-12���ڸ��¶�ʱ��pH=9��NaOH��Һa L��pH=2��H2SO4��ҺbL���(���Ի�Ϻ���Һ����ı仯���������û����Һ��pH=3,���a��b=_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���-ͭ����ȼ�ϵ�������ߡ��ɱ��ͣ����й����ķ�չǰ�����õ�ع���ʱ�������ӵ�ͭ��ʴ������ܷ�ӦΪ��2Li+Cu2O+H2O=2Cu+2Li��+2OH�����乤��ԭ����ͼ��ʾ������˵������ȷ���ǣ� ��
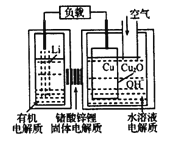
A. ��طŵ�ʱ������������ҺpH����
B. ����ʱ��Li��������������Cu���ƶ�
C. ��طŵ�����У������е�O2�����μӷ�Ӧ
D. �������л�����ʺ�ˮ��Һ����ʲ��ɶԻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����������ҵ������������ҪӦ�á���ش��������⣺
(1)��ͼ��N2(g)��H2(g)��NH3(g)֮��ת����������ϵͼ����
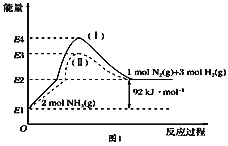
��N2(g)��H2(g)��Ӧ����NH3(g)���Ȼ�ѧ����ʽΪ___________________.
�ڹ���(��)����(��)�ķ�Ӧ��________(���ͬ����ͬ��).
��ij�¶��£���1 L���º��������г���1molN2��3 mol H2����������Ӧ��10 min�ﵽƽ�⣬��ʱ������ѹǿ��Ϊԭ����7/8.
a.�ù��̵�ƽ�ⳣ���ı���ʽΪ____________.
b.N2��ƽ��ת����Ϊ________.
c.��ʱ�����������¶Ⱥ�������䣬�������ټ���2.25 molN2��0.5 mol NH3����ƽ��________(�����������)�ƶ�.
(2)��NH3�������������������Ⱦ����֪��
��Ӧ��4NH3(g)��3O2(g)![]() 2N2(g)��6H2O(g) ��H1��a kJ��mol��1 ƽ�ⳣ��ΪK1
2N2(g)��6H2O(g) ��H1��a kJ��mol��1 ƽ�ⳣ��ΪK1
��Ӧ��N2(g)��O2(g)![]() 2NO(g) ��H2��b kJ��mol��1 ƽ�ⳣ��ΪK2
2NO(g) ��H2��b kJ��mol��1 ƽ�ⳣ��ΪK2
��Ӧ��4NH3(g)��6NO(g)![]() 5N2(g)��6H2O(g) ��H3��c kJ��mol��1 ƽ�ⳣ��ΪK3
5N2(g)��6H2O(g) ��H3��c kJ��mol��1 ƽ�ⳣ��ΪK3
��Ӧ���е�b��_____(�ú�a��c�Ĵ���ʽ��ʾ)��K3=_____(��K1��K2��ʾ).��Ӧ���еĦ�S______(�>����<������)0.
(3)�ں��ݵ��ܱ����У�����һ������NH3��NO����������Ӧ��ò�ͬ�¶��·�Ӧ��ϵ��NH3��ת����(��)��ѹǿp�Ĺ�ϵ��ͼ��ʾ��
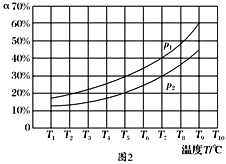
�ٷ�����p1________p2.(�>����<������)
�����������У�������Ϊ�жϷ�Ӧ���Ѿ��ﵽƽ��״̬�ı�־����________(�����).
a��N2��Ũ�Ȳ��ٸı� b������6 mol N��H����ͬʱ����6 mol H��O���γ�
c��������ѹǿ���ٱ仯 d�����������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������ĵ���ʽΪ_____����ռ�ṹΪ_____����ϩ�Ľṹ��ʽΪ_____����ϩͨ����ˮ�еĻ�ѧ����ʽΪ_____���䷴Ӧ����Ϊ_____��C5H12������_____��ͬ���칹��
��2��һװ�е���������ͼ������Ͳ������ʢˮ��ˮ���У���������һ��ʱ��ɹ۲쵽����������Ͳ��������ɫ��dz��_____��_____����Ͳ��Һ��������д���÷�Ӧ����һ�ȼ���Ļ�ѧ����ʽ_____���÷�Ӧ����Ϊ_____��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com