

| 1 |
| 2 |
| 500 |
| 25 |
| 1 |
| 2 |
| 500 |
| 25 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、化合物:CaCl2、烧碱、聚苯乙烯、HD | ||||||
| B、电解质:明矾、胆矾、冰醋酸、硫酸钡 | ||||||
| C、同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2 | ||||||
D、同位素:
|
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、当有01mol电子转移时,a极产生1.21LO2(标准状况下) |
| B、b极上发生的电极反应是:4H2O+4e-=2H2↑+4OH- |
| C、c极发生的电极反应是:O2+2H2O+4e-=4OH- |
| D、d极上进行氧化反应,B中的H+可以通过隔膜进入A |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5-3 | +7-1 | +5-3 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
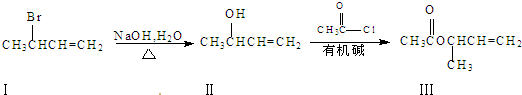
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、植物油不能使溴的四氯化碳溶液褪色 |
| B、淀粉水解的最终产物是葡萄糖 |
| C、葡萄糖能发生水解和氧化反应 |
| D、蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com