
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)向沸水中逐滴滴加1mol·L-1FeCl3溶液至液体呈透明的红褐色,所得分散系中微粒直径的范围是______________,区别该液体和FeCl3溶液的方法是______________。
(2)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() Fe3O4+6SO2,氧化产物为________,若有3mol FeS2参加反应,转移________mol电子。
Fe3O4+6SO2,氧化产物为________,若有3mol FeS2参加反应,转移________mol电子。
(3)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
___FeSO4+____KNO3+___H2SO4═____K2SO4+_____Fe2(SO4)3+__NO↑+_____H2O。
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L(标准状况)H2,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为________g。
【答案】1nm~100nm 丁达尔效应 SO2、Fe3O4 32 6 2 4 1 3 2 4 11.2
【解析】
向沸水中逐滴滴加1mol·L-1FeCl3溶液至液体呈透明的红褐色制备氢氧化铁胶体。反应3FeS2+8O2![]() Fe3O4+6SO2中氧元素的化合价降低,铁元素、硫元素化合价升高。氧化还原反应配平根据得失电子数相等。
Fe3O4+6SO2中氧元素的化合价降低,铁元素、硫元素化合价升高。氧化还原反应配平根据得失电子数相等。
(1)反应制得氢氧化铁胶体,胶体中微粒直径的范围是1-100nm;丁达尔效应为胶体的特性,故可以利用丁达尔效应区别氢氧化铁胶体和氯化铁溶液。
(2)3FeS2+8O2![]() Fe3O4+6SO2中,铁元素由+2价变为+3价,化合价升高;硫元素由-1价变为+4价,化合价升高;氧元素由0价变为-2价,化合价降低。故FeS2作还原剂,O2作氧化剂,Fe3O4、SO2既是氧化产物也是还原产物;在上述反应中共转移32个电子,若有3mol FeS2参加反应,则转移32mol电子。
Fe3O4+6SO2中,铁元素由+2价变为+3价,化合价升高;硫元素由-1价变为+4价,化合价升高;氧元素由0价变为-2价,化合价降低。故FeS2作还原剂,O2作氧化剂,Fe3O4、SO2既是氧化产物也是还原产物;在上述反应中共转移32个电子,若有3mol FeS2参加反应,则转移32mol电子。
(3)反应中铁元素由+2价变为+3价,氮元素由+5价变为+2价,根据得失电子数相等和元素守恒,得化学方程式6FeSO4+2KNO3+4H2SO4═K2SO4+3Fe2(SO4)3+2NO↑+4H2O。
(4)生成氢气的物质的量为0.1mol。根据反应Fe+2HCl=FeCl2+H2,可知与盐酸反应Fe的物质的量为0.1mol、HCl物质的量为0.2mol,根据氯原子守恒,氯化铁的物质的量为![]() 。根据反应Fe+2Fe3+=3Fe2+,可知与三价铁离子反应的Fe的物质的量为0.1mol,故参与反应Fe的总物质的量为0.2mol,质量为11.2g。
。根据反应Fe+2Fe3+=3Fe2+,可知与三价铁离子反应的Fe的物质的量为0.1mol,故参与反应Fe的总物质的量为0.2mol,质量为11.2g。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池。其结构如图所示,放电时的电池反应为PbO2+Pb+2H2SO4=2PbSO4+2H2O。根据此反应判断下列说法正确的是( )

A.PbO2是电池的负极
B.Pb是电池的负极
C.PbO2得电子,被氧化
D.电池放电时,溶液的酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是一种极活泼的金属,其化合物种类繁多。请回答:
(1)钠元素的金属性比铝______(填“强”或“弱”),钠元素灼烧时火焰呈______色。
(2)将一小块金属钠投入水中,现象描述正确的是_________。
A.钠沉到水底
B.钠熔成小球
C.小球静止不动
D.发出嘶嘶响声
(3)钠在氧气中燃烧的化学方程式为________________________。
(4)有关Na2O2的性质及用途描述错误的是_________。
A.作供氧剂
B.有漂白性
C.作干燥剂
D.有较强氧化性
(5)等质量的Na2CO3和NaHCO3固体分别与足量盐酸反应,产生气体多的是_______(填“Na2CO3”或“NaHCO3”)。
(6)NaHCO3溶液与稀HCl反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COONa溶液和NaCN溶液,所得滴定曲线如图(忽略体积变化)。下列说法正确的是( )
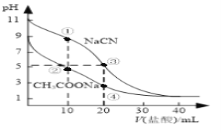
A. 溶液中阳离子的物质的量浓度之和:点②等于点③
B. 点①所示溶液中:c(CN-)+c(HCN)﹤2c(Cl-)
C. 点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)>c(CH3COOH)
D. 点④所示溶液中:c(Na+)+c(CH3COOH)+c(H+)>0.10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
深井岩盐的主要配料为:精制盐、碘酸钾(KIO3)、亚铁氰化钾[K4Fe(CN)6·3H2O]。其中亚铁氰化钾的无水盐在高温下会发生分解:3K4[Fe(CN)6]![]() 2(CN)2↑+12KCN+N2↑+Fe3C+C
2(CN)2↑+12KCN+N2↑+Fe3C+C
请回答下列问题:
(1)①Fe2+基态核外电子排布式为_____。
②![]() 的空间构型为______(用文字描述)。
的空间构型为______(用文字描述)。
③(CN)2分子中碳原子杂化轨道类型为_______,一种与CN-互为等电子体的分子的电子式为_______。
④1molFe(CN)63中含有σ键的数目为____mol。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=___。Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于____(填晶体类型)。
(3)如图是从铁氧体离子晶体Fe3O4中取出的能体现其晶体结构的一个立方体,则该立方体是不是Fe3O4的晶胞______(填“是”或“否”),立方体中三价铁离子处于氧离子围成的________(填空间结构)空隙。
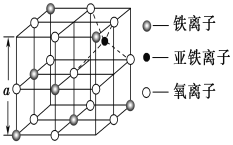
(4)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71gcm﹣3,晶胞边长为4.28×10﹣10 m,则FexO中x=____。(用代数式表示,不要求算出具体结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 异丙基的结构简式:-CH(CH3)2
C. 羟基的电子式: ![]() D. 新戊烷的结构简式:
D. 新戊烷的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】艾司洛尔(I )是预防和治疗手术期心动过速的一种药物,某合成路线如下:
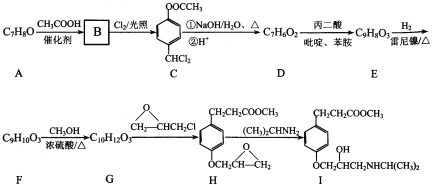
回答下列问题:
(1)A的结构简式为_____________________,D 的化学名称为__________________。
(2)G→H的反应类型为_______________,H中所含官能团的名称为______________。
(3)C→D中步骤①的化学反应方程式为_________________。
(4)已知:1 mol D 和1 mol 丙二酸在吡啶、苯胺中反应生成 1 mol E、1 mol H2O和1 molCO2,且E 能与溴水发生加成反应,则 E 的结构简式为 ____________。
(5)X是F的同分异构体,写出满足下列条件的 X 的结构简式________。①与碳酸氢钠溶液反应生成二氧化碳②与FeC13溶液发生显色反应③核磁共振氢谱有四组峰且峰面积之比为 6 : 2 : 1 : 1
(6)参照上述合成路线,设计以![]() 和
和![]() 为主要原料制备
为主要原料制备![]() 的合成路线______。
的合成路线______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,现用足量浓盐酸与8.7 g二氧化锰完全反应制取氯气(假设Cl2全部逸出)。求:
MnCl2+Cl2↑+2H2O,现用足量浓盐酸与8.7 g二氧化锰完全反应制取氯气(假设Cl2全部逸出)。求:
(1)产生多少升氯气(标准状况)?____________________
(2)把产生的氯气通入足量NaOH溶液中,假设氯气全部参加反应,可产生多少mol NaClO?____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证同主族元素性质的递变规律。某小组用如图所示的装置进行实验(夹持仪器已略去,装置气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当装置B和装置C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当装置B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)浸有NaOH溶液的棉花的作用____________________________。
(2)装置A中发生的置换反应的化学方程式为___________________。
(3)装置B的溶液中NaBr完全被氧化,则消耗Cl2的物质的量为__________。
(4)为验证溴元素的非金属性强于碘元素,过程Ⅳ的操作和现象是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com