
【题目】钠是一种极活泼的金属,其化合物种类繁多。请回答:
(1)钠元素的金属性比铝______(填“强”或“弱”),钠元素灼烧时火焰呈______色。
(2)将一小块金属钠投入水中,现象描述正确的是_________。
A.钠沉到水底
B.钠熔成小球
C.小球静止不动
D.发出嘶嘶响声
(3)钠在氧气中燃烧的化学方程式为________________________。
(4)有关Na2O2的性质及用途描述错误的是_________。
A.作供氧剂
B.有漂白性
C.作干燥剂
D.有较强氧化性
(5)等质量的Na2CO3和NaHCO3固体分别与足量盐酸反应,产生气体多的是_______(填“Na2CO3”或“NaHCO3”)。
(6)NaHCO3溶液与稀HCl反应的离子方程式为________________________。
【答案】强 黄 BD 2Na + O2 ![]() Na2O2 C NaHCO3
Na2O2 C NaHCO3 ![]() + H+ ═ H2O + CO2↑
+ H+ ═ H2O + CO2↑
【解析】
(1)钠与铝是同周期元素,依据元素周期律,同周期元素从左往右,金属性依次减弱,从而得出钠与铝的金属性强弱,钠元素灼烧时火焰呈黄色。
(2)将一小块金属钠投入水中,现象为浮、熔、游、响、红。
(3)钠在氧气中燃烧生成过氧化钠。
(4)Na2O2能与CO2和水反应生成氧气,所以可作供氧剂、强氧化剂。
(5)等质量的Na2CO3和NaHCO3固体分别与足量盐酸反应,都生成CO2,且生成CO2的物质的量与固体中所含碳的物质的量相等。
(6)NaHCO3溶液与稀HCl反应,生成氯化钠、水和二氧化碳气体。
(1)钠与铝是同周期元素,且钠在铝的左边,所以钠元素的金属性比铝强,钠元素灼烧时火焰呈黄色。答案为:强;黄;
(2)将一小块金属钠投入水中,现象为浮、熔、游、响、红,故选BD。答案为:BD;
(3)钠在氧气中燃烧生成过氧化钠,化学方程式为2Na+O2![]() Na2O2。答案为:2Na+O2
Na2O2。答案为:2Na+O2![]() Na2O2;
Na2O2;
(4) Na2O2能与CO2和水反应生成氧气,所以可作供氧剂、具有漂白性和强氧化性,但不能作干燥剂,故选C。答案为:C;
(5) Na2CO3和NaHCO3固体分别与足量盐酸反应,都生成CO2,且生成CO2的物质的量与固体中所含碳的物质的量相等。等质量时,Na2CO3的物质的量比NaHCO3小,所以产生气体多的是NaHCO3。答案为:NaHCO3;
(6)NaHCO3溶液与稀HCl反应,生成氯化钠、水和二氧化碳气体,离子方程式为![]() + H+ ═ H2O + CO2↑。答案为:
+ H+ ═ H2O + CO2↑。答案为:![]() + H+ ═ H2O + CO2↑。
+ H+ ═ H2O + CO2↑。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】425℃时,在两个1L密闭容器中分别发生化学反应,物质的浓度随时间的变化如图所示。下列叙述错误的是( )

A.图①中t0时,三种物质的物质的量相等
B.图①中![]() 时,反应达到平衡状态
时,反应达到平衡状态
C.图②中的可逆反应为2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
D.图①②中,当c(HI)=3.16mol/L时,两容器中的反应均达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH4+):③>①
B. 水电离出的c(H+):②>①
C. ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计以下两套装置用乙醇、乙酸和浓硫酸分别制备乙酸乙酯(沸点77.2℃)。下列说法不正确的是

A. 浓硫酸能加快酯化反应速率 B. 不断蒸出酯,会降低其产率
C. 装置b比装置a原料损失的少 D. 可用分液的方法分离出乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶胞是晶体结构中可重复出现的最小的结构单元,C60晶胞结构如下图所示,下列说法正确的是( )
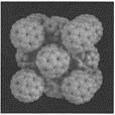
A. C60摩尔质量是720
B. C60与苯互为同素异形体
C. 在C60晶胞中有14个C60分子
D. 每个C60分子周围与它距离最近等距离的C60分子有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的硬度常用一种规定的标准来衡量:将水中的Ca2+、Mg2+都看作Ca2+,并将其质量折算成CaO的质量,通常把1L水中含有10mgCaO称为1°,1L水中含有20mgCaO即为2°,以此类推,8°以上为硬水,8°以下为软水,Ca2+、Mg2+的硬度之和称为总硬度。用配位滴定法分析某水样(含有Ca2+、Mg2+、Fe3+、Cl-、SO42-、HCO3-)的硬度时,取50.00mL水样放入250mL锥形瓶中,加入稀盐酸数滴,煮沸,冷却,加入2mL1∶1的三乙醇胺溶液和10mLNH3·H2O—NH4Cl缓冲溶液(pH=10)及3滴酸性铬蓝K素酚绿B混合指示剂,用0.01000mol·L-1 EDTA溶液滴定至由红色到蓝色即终点,消耗EDTA溶液12.5mL。另取水样50.00mL,将上述操作中加入缓冲溶液改为加入20%的NaOH溶液使pH>12,用0.01000mol·L-1 EDTA溶液滴定至终点,消耗EDTA溶液7.50mL。(已知Ca2+、Mg2+、Fe3+与EDTA反应的化学计量比均为1∶1)
(1)日常生活中可用____检验某水样是硬水还是软水。
(2)加入数滴稀盐酸并煮沸的目的是______。
(3)加入三乙醇胺溶液的目的是_____。
(4)试计算水样钙硬度和水样总硬度(写出计算过程)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学中常见的四种物质,且A、B、C中含有同一种元素,其转化关系如图所示。下列说法正确的是( )
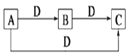
A. 若B为一种两性氢氧化物,则D可能是强酸,也可能是强碱
B. 若A为固态非金属单质,D为O2,则A可以为单质硫
C. 若A为强碱,D为CO2,则B的溶解度一定大于C的溶解度
D. 若A为18电子气态氢化物,D为O2,则A只能是C2H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)向沸水中逐滴滴加1mol·L-1FeCl3溶液至液体呈透明的红褐色,所得分散系中微粒直径的范围是______________,区别该液体和FeCl3溶液的方法是______________。
(2)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料。其中一个反应为3FeS2+8O2![]() Fe3O4+6SO2,氧化产物为________,若有3mol FeS2参加反应,转移________mol电子。
Fe3O4+6SO2,氧化产物为________,若有3mol FeS2参加反应,转移________mol电子。
(3)在热的稀硫酸溶液中溶解一定量的FeSO4后,再加入足量的KNO3溶液,可使其中的Fe2+全部转化成Fe3+,并有气体逸出,请配平该化学方程式:
___FeSO4+____KNO3+___H2SO4═____K2SO4+_____Fe2(SO4)3+__NO↑+_____H2O。
(4)铁红是一种红色颜料,其成分是Fe2O3,将一定量的铁红溶于160mL 5mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L(标准状况)H2,经检测,溶液中无Fe3+,则参加反应的铁粉的质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的是( )


A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com