
【题目】水的硬度常用一种规定的标准来衡量:将水中的Ca2+、Mg2+都看作Ca2+,并将其质量折算成CaO的质量,通常把1L水中含有10mgCaO称为1°,1L水中含有20mgCaO即为2°,以此类推,8°以上为硬水,8°以下为软水,Ca2+、Mg2+的硬度之和称为总硬度。用配位滴定法分析某水样(含有Ca2+、Mg2+、Fe3+、Cl-、SO42-、HCO3-)的硬度时,取50.00mL水样放入250mL锥形瓶中,加入稀盐酸数滴,煮沸,冷却,加入2mL1∶1的三乙醇胺溶液和10mLNH3·H2O—NH4Cl缓冲溶液(pH=10)及3滴酸性铬蓝K素酚绿B混合指示剂,用0.01000mol·L-1 EDTA溶液滴定至由红色到蓝色即终点,消耗EDTA溶液12.5mL。另取水样50.00mL,将上述操作中加入缓冲溶液改为加入20%的NaOH溶液使pH>12,用0.01000mol·L-1 EDTA溶液滴定至终点,消耗EDTA溶液7.50mL。(已知Ca2+、Mg2+、Fe3+与EDTA反应的化学计量比均为1∶1)
(1)日常生活中可用____检验某水样是硬水还是软水。
(2)加入数滴稀盐酸并煮沸的目的是______。
(3)加入三乙醇胺溶液的目的是_____。
(4)试计算水样钙硬度和水样总硬度(写出计算过程)。_____
【答案】肥皂水 除去HCO3-并赶走CO2 除去Fe3+ 8.4°、14°
【解析】
在用NH3·H2O—NH4Cl缓冲溶液时滴定的是溶液中的Ca2+、Mg2+,测定的是水样总硬度;将缓冲溶液改为加入20%的NaOH溶液使pH>12,使镁离子沉淀,再用EDTA溶液滴定钙离子浓度,测定的是水样钙硬度,据此分析解答。
(1) 肥皂的主要成分是高级脂肪酸盐,遇到硬水会产生沉淀,日常生活中可用肥皂水检验某水样是硬水还是软水,故答案为:肥皂水;
(2)加入数滴稀盐酸并煮沸,可以除去溶液中的HCO3-并赶走CO2,否则当HCO3-含量高时,加入NH3·H2O—NH4Cl缓冲溶液后会析出碳酸钙沉淀,使测得的结果偏小,故答案为:除去HCO3-并赶走CO2;
(3)加入三乙醇胺溶液,可以除去Fe3+,防止Fe3+干扰实验,故答案为:除去Fe3+;
(4) Ca2+、Mg2+、Fe3+与EDTA反应的化学计量比均为1∶1,即存在关系Ca2+(或Mg2+)~EDTA,pH=10时,消耗EDTA的物质的量=0.0125L×0.01000mol·L-1 =0.000125mol,则50.00mL水样中含有Ca2+、Mg2+共0.000125mol,折算成CaO为0.000125mol,质量为0.000125mol×56g/mol=0.007g=7mg,则1L水中含有7mg×![]() =140mgCaO,水样总硬度为14°;另取水样50.00mL,将上述操作中加入缓冲溶液改为加入20%的NaOH溶液使pH>12,使镁离子沉淀,再用EDTA溶液滴定钙离子浓度,消耗EDTA的物质的量=0.0075L×0.01000mol·L-1 =0.000075mol,则50.00mL水样中含有Ca2+0.000075mol,折算成CaO为0.000075mol,质量为0.000075mol×56g/mol=0.0042g=4.2mg,则1L水中含有4.2mg×
=140mgCaO,水样总硬度为14°;另取水样50.00mL,将上述操作中加入缓冲溶液改为加入20%的NaOH溶液使pH>12,使镁离子沉淀,再用EDTA溶液滴定钙离子浓度,消耗EDTA的物质的量=0.0075L×0.01000mol·L-1 =0.000075mol,则50.00mL水样中含有Ca2+0.000075mol,折算成CaO为0.000075mol,质量为0.000075mol×56g/mol=0.0042g=4.2mg,则1L水中含有4.2mg×![]() =84mgCaO,水样钙硬度为8.4°,故答案为:8.4°、14°。
=84mgCaO,水样钙硬度为8.4°,故答案为:8.4°、14°。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】已知汽车尾气无害化处理反应为2NO(g)+2CO(g) ![]() N2(g)+2CO2(g)。下列说法正确的是
N2(g)+2CO2(g)。下列说法正确的是
A.升高温度可使该反应的逆反应速率降低
B.达到化学平衡时,化学反应已经停止
C.v正(NO)=v正(CO2)时,说明达到了化学平衡
D.单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中不正确的是( )

A.a点表示的溶液中c(CH3COO-)略小于10-3 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中![]() 均等于K
均等于K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体型分子且键角都为109.5°
C. NH4+的电子式为 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠是一种极活泼的金属,其化合物种类繁多。请回答:
(1)钠元素的金属性比铝______(填“强”或“弱”),钠元素灼烧时火焰呈______色。
(2)将一小块金属钠投入水中,现象描述正确的是_________。
A.钠沉到水底
B.钠熔成小球
C.小球静止不动
D.发出嘶嘶响声
(3)钠在氧气中燃烧的化学方程式为________________________。
(4)有关Na2O2的性质及用途描述错误的是_________。
A.作供氧剂
B.有漂白性
C.作干燥剂
D.有较强氧化性
(5)等质量的Na2CO3和NaHCO3固体分别与足量盐酸反应,产生气体多的是_______(填“Na2CO3”或“NaHCO3”)。
(6)NaHCO3溶液与稀HCl反应的离子方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D四种短周期元素的原子半径依次减小,D能分别与A,B,C形成电子总数相等的分子X、Y、Z。C原子的最外层电子排布为nsnnp2n。E的原子序数为29。
(1)A,B,C的第一电离能由小到大的顺序为________(用元素符号表示)。
(2)X是含有________键(填“非极性”或“极性”,下同)的________分子。
(3)A的一种氢化物的相对分子质量为26,其分子中的σ键与π键的键数之比为________。
(4)Y分子的空间构型为__________,其中心原子采取________杂化。
(5)一种由B,C组成的化合物与AC2互为等电子体,其化学式为________。
(6)Y是一种易液化的气体,请简述其易液化的原因_________。
(7)写出E2+的电子排布式___________________,并写出E2+在Z中通入足量Y得到深蓝色溶液的离子反应方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1CH3COONa溶液和NaCN溶液,所得滴定曲线如图(忽略体积变化)。下列说法正确的是( )
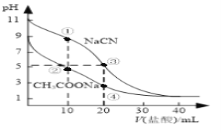
A. 溶液中阳离子的物质的量浓度之和:点②等于点③
B. 点①所示溶液中:c(CN-)+c(HCN)﹤2c(Cl-)
C. 点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)>c(CH3COOH)
D. 点④所示溶液中:c(Na+)+c(CH3COOH)+c(H+)>0.10mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语正确的是( )
A. 乙烯的结构简式:CH2CH2 B. 异丙基的结构简式:-CH(CH3)2
C. 羟基的电子式: ![]() D. 新戊烷的结构简式:
D. 新戊烷的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。下列说法正确的是
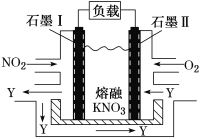
A. 放电时,NO3-向石墨Ⅱ电极迁移
B. 石墨Ⅱ附近发生的反应为NO+O2+e-===NO3-
C. 该电池总反应式为4NO2+O2===2N2O5
D. 当外电路通过4 mol e-时,负极上共产生2mol N2O5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com