
【题目】NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。下列说法正确的是
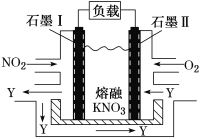
A. 放电时,NO3-向石墨Ⅱ电极迁移
B. 石墨Ⅱ附近发生的反应为NO+O2+e-===NO3-
C. 该电池总反应式为4NO2+O2===2N2O5
D. 当外电路通过4 mol e-时,负极上共产生2mol N2O5
【答案】C
【解析】
NO2、O2和熔融KNO3可制作燃料电池,NO2为燃料,作还原剂,失电子,发生氧化反应,O2作氧化剂,得电子,发生还原反应,由此判断石墨Ⅰ作负极,电极反应式为:NO2+NO3--e-=N2O5,石墨Ⅱ作正极,电极反应式为:O2+2N2O5+4e-=4NO3-,据此答题。
A.O2在石墨Ⅱ附近得电子,发生还原反应,石墨电极Ⅱ为电池的正极,石墨电极Ⅰ为电池的负极,该电池放电时NO3-向石墨Ⅰ电极迁移,故A错误;
B.O2在石墨Ⅱ附近得电子,发生还原反应,电极方程式为:NO2+NO3--e-=N2O5,故B错误;
C.由分析可知,电池总反应方程式为:4NO2+O2=2N2O5,故C正确;
D.由负极电极方程式NO2+NO3--e-=N2O5可知,电路每通过4mole-时,负极上共产生4molN2O5,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】水的硬度常用一种规定的标准来衡量:将水中的Ca2+、Mg2+都看作Ca2+,并将其质量折算成CaO的质量,通常把1L水中含有10mgCaO称为1°,1L水中含有20mgCaO即为2°,以此类推,8°以上为硬水,8°以下为软水,Ca2+、Mg2+的硬度之和称为总硬度。用配位滴定法分析某水样(含有Ca2+、Mg2+、Fe3+、Cl-、SO42-、HCO3-)的硬度时,取50.00mL水样放入250mL锥形瓶中,加入稀盐酸数滴,煮沸,冷却,加入2mL1∶1的三乙醇胺溶液和10mLNH3·H2O—NH4Cl缓冲溶液(pH=10)及3滴酸性铬蓝K素酚绿B混合指示剂,用0.01000mol·L-1 EDTA溶液滴定至由红色到蓝色即终点,消耗EDTA溶液12.5mL。另取水样50.00mL,将上述操作中加入缓冲溶液改为加入20%的NaOH溶液使pH>12,用0.01000mol·L-1 EDTA溶液滴定至终点,消耗EDTA溶液7.50mL。(已知Ca2+、Mg2+、Fe3+与EDTA反应的化学计量比均为1∶1)
(1)日常生活中可用____检验某水样是硬水还是软水。
(2)加入数滴稀盐酸并煮沸的目的是______。
(3)加入三乙醇胺溶液的目的是_____。
(4)试计算水样钙硬度和水样总硬度(写出计算过程)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A. H2S 的电离方程式:H2S+H2O![]() H3O++HS-
H3O++HS-
B. NaHCO3在水溶液中的电离方程式:NaHCO3= Na++H++CO32-
C. CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D. HS-的水解方程式:HS-+H2O![]() S2-+H3O+
S2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·molˉ1,下列说法不正确的是
A.CO(g)+![]() O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
B.2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ
C.相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量
D.拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的是( )


A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图。下列说法错误的是 ( )

A.简单离子半径:Z<Y
B.简单气态氢化物的热稳定性:Y>X
C.a一定是烃
D.d中既含有离子键又含有共价键,其中阳离子和阴离子的数目之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下Ksp(AgCl)=1.6×10-10、Ksp(AgI)=2.0×10-16,下列说法中正确的是
A.含有大量Cl-的溶液中肯定不存在Ag+
B.AgI悬浊液中加入少量KI粉末,平衡AgI(s)![]() Ag+(aq)+I-(aq)向左移动,溶液中离子的总浓度会减小
Ag+(aq)+I-(aq)向左移动,溶液中离子的总浓度会减小
C.AgCl悬浊液中逐渐加入KI固体至c(I-)=Ksp(AgI)/Ksp(AgCl)mol·L-1时,AgCl开始向AgI沉淀转化
D.向浓度均为0.01 mol·L-1的KCl和KI的混合溶液中滴加AgNO3溶液,当Cl-开始沉淀时,溶液中I-的浓度为1.25×10-8 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.H2A在水中存在以下平衡:H2A![]() H+ +HA- ,HA-
H+ +HA- ,HA-![]() H++A2- 。
H++A2- 。
(1)NaHA溶液显酸性,则溶液中离子浓度的大小顺序为____________________。
(2)常温时,若向0.1 mol/L的NaHA溶液中逐滴滴加0.1mol/L KOH溶液至溶液呈中性。此时该混合溶液的下列关系中,一定正确的是_______________。
A.c(Na+ )>c(K+) B.c(H +)c(OH)=1×10-14
C.c(Na+ )=c(K+) D.c(Na+ )+c(K+ )=c(HA-)+c(A2- )
(3)已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)![]() Ca2+ (aq)+A2- (aq),滴加少量Na2A固体,c(Ca2+ )_______________(填“增大”、“减小”或“不变”),原因是________________。
Ca2+ (aq)+A2- (aq),滴加少量Na2A固体,c(Ca2+ )_______________(填“增大”、“减小”或“不变”),原因是________________。
Ⅱ.含有Cr2O72-的废水毒性较大,某工厂废水中含4.00×10-3 mol/L的Cr2O72-。为使废水能达标排放,作如下处理:![]()
(1)该废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为:_______________。
(2)欲使25 L该废水中Cr2O7 转化为Cr3+,理论上需要加入__________g FeSO4·7H2O。
(3)若处理后的废水中残留的c(Fe)=1×10-13mol/L,则残留的 Cr3+ 的浓度为__________。(已知:Ksp[Fe(OH)3]≈1.0×10-38mol/L,Ksp[Cr(OH)3]≈1.0×10-31 mol/L )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两种化合物的结构或性质描述正确的是
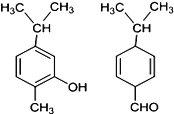
A. 两种化合物均是芳香烃
B. 两种化合物可用红外光谱区分,但不能用核磁共振氢谱区分
C. 两种化合物分子中共平面的碳原子数相同
D. 两种化合物互为同分异构体,均能与溴水反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com