
【题目】短周期元素 W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d是淡黄色粉末,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图。下列说法错误的是 ( )

A.简单离子半径:Z<Y
B.简单气态氢化物的热稳定性:Y>X
C.a一定是烃
D.d中既含有离子键又含有共价键,其中阳离子和阴离子的数目之比为2∶1
【答案】C
【解析】
短周期元素W、X、Y、Z的原子序数依次递增,a、b、c、d、e、f是由这些元素组成的化合物,d是淡黄色粉末,d为过氧化钠;m为元素Y的单质,通常为无色无味的气体,则m为氧气,故Y为O;根据图示转化关系可知:a为烃或烃的含氧衍生物,b、c为二氧化碳、水中的一种,e、f分别为碳酸钠、氢氧化钠中的一种,结合原子序数可知,W为H,X为C,Y为O,Z为Na,据此解答。
A.Z、Y的离子具有相同的电子层结构,原子序数越大,其相应的离子半径就越小,所以简单离子半径:Z<Y,A正确;
B.元素非金属性越强,其对应的简单氢化物越稳定,由于元素的非金属性Y>X,所以简单气态氢化物的热稳定性:Y>X,B正确;
C.a不一定是烃,C错误;
D.过氧化钠为离子化合物,含有离子键和共价键,含有阳离子钠离子和阴离子过氧根离子,阳离子和阴离子的数目之比为2∶1,D正确;
答案选C。


 精英口算卡系列答案
精英口算卡系列答案科目:高中化学 来源: 题型:
【题目】A,B,C,D四种短周期元素的原子半径依次减小,D能分别与A,B,C形成电子总数相等的分子X、Y、Z。C原子的最外层电子排布为nsnnp2n。E的原子序数为29。
(1)A,B,C的第一电离能由小到大的顺序为________(用元素符号表示)。
(2)X是含有________键(填“非极性”或“极性”,下同)的________分子。
(3)A的一种氢化物的相对分子质量为26,其分子中的σ键与π键的键数之比为________。
(4)Y分子的空间构型为__________,其中心原子采取________杂化。
(5)一种由B,C组成的化合物与AC2互为等电子体,其化学式为________。
(6)Y是一种易液化的气体,请简述其易液化的原因_________。
(7)写出E2+的电子排布式___________________,并写出E2+在Z中通入足量Y得到深蓝色溶液的离子反应方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )
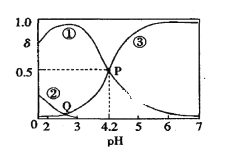
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. 20℃时,H2C2O4的二级电离平衡常数Ka2=1×10-4.2
C. Q点对应溶液中lgc(H+)<lgc(OH-)
D. 0.100mol·L-1的NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是

A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用。下列说法正确的是
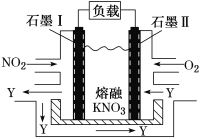
A. 放电时,NO3-向石墨Ⅱ电极迁移
B. 石墨Ⅱ附近发生的反应为NO+O2+e-===NO3-
C. 该电池总反应式为4NO2+O2===2N2O5
D. 当外电路通过4 mol e-时,负极上共产生2mol N2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知五种元素的原子序数的大小顺序为C>A>B>D>E,A、C同周期,B、C同主族;A与B形成离子化合物,A2B中所有离子的电子数相同,其电子总数为30;D和E可形成4核10电子的分子。试回答下列问题:
(1)写出下列物质的电子式:
D的单质:_________________;
A、B、E形成的化合物:________________;
D、E形成的化合物:___________________。
(2)A、B两元素组成的化合物A2B2存在的化学键是_______________。
(3)铝与A的最高价氧化物的水化物在水溶液中反应的离子方程式为:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaClO2在水溶液中能发生水解。常温时,有1 mol/L的HClO2溶液和1mol/L的HBF4(氟硼酸)溶液起始时的体积均为V0,分别向两溶液中加水,稀释后溶液的体积为V,所得曲线如图所示。下列说法错误的是
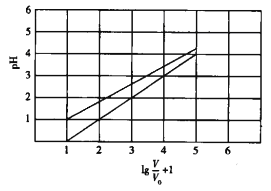
A. HClO2为弱酸,HBF4为强酸
B. 常温下HClO2的电高平衡常数的数量级为10—4
C. 在0≤pH≤5时,HBF4溶液满足pH=lg(V/V0)
D. 25℃时1L pH=2的HBF4溶液与100℃时1L pH=2的HBF4溶液消耗的NaOH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下向20mL 0.1mol/L氨水中通入HCl气体,溶液中由水电离出的氢离子浓度随通入HCl气体的体积变化如图所示。则下列说法正确的是
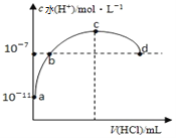
A. b点通入的HCl气体,在标况下为44.8mL
B. b、c之间溶液中c(NH4+)>c(Cl-)
C. 取10mL的c点溶液稀释时:c(NH4+)/c(NH3·H2O)减小
D. d点溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀硫酸,并测得混合液的导电能力随时间变化曲线如图,该小组同学据图分析错误的是

A.AB段溶液的导电能力不断减弱,说明电解质逐渐转变为非电解质
B.B处的导电能力为0,说明溶液中几乎没有自由移动的离子
C.BC段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电
D.a时刻Ba(OH)2溶液中与稀硫酸恰好完全中和
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com