
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体型分子且键角都为109.5°
C. NH4+的电子式为 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
【题目】下列哪种说法可以证明反应N2+3H2![]() 2NH3达到平衡状态
2NH3达到平衡状态
A.1个N≡N键形成的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有6个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法淡化海水装置示意图如下,电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。下列说法正确的是( )
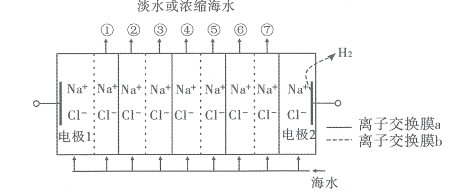
A. 离子交换膜b为阳离子交换膜
B. 各间隔室的排出液中,①③⑤⑦为淡水
C. 通电时,电极l附近溶液的pH比电极2附近溶液的pH变化明显
D. 淡化过程中,得到的浓缩海水没有任何使用价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙烯分子中含有一个碳碳双键的事实是( )。
A.乙烯分子中碳、氢原子个数比为![]()
B.乙烯完全燃烧生成的![]() 和水的物质的量相等
和水的物质的量相等
C.乙烯易与![]() 发生加成反应,且
发生加成反应,且![]() 乙烯完全加成需要消耗
乙烯完全加成需要消耗![]()
D.乙烯能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计以下两套装置用乙醇、乙酸和浓硫酸分别制备乙酸乙酯(沸点77.2℃)。下列说法不正确的是

A. 浓硫酸能加快酯化反应速率 B. 不断蒸出酯,会降低其产率
C. 装置b比装置a原料损失的少 D. 可用分液的方法分离出乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列提供了有关物质的熔点,根据表中的数据,下列判断错误的是

A. AlF3晶体是离子晶体,AlCl3晶体是分子晶体
B. AlF3晶体的晶格能小于NaCl晶体的晶格能
C. 同族元素的氧化物可以形成不同类型的晶体
D. 不同族元素的氯化物可以形成相同类型的晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的硬度常用一种规定的标准来衡量:将水中的Ca2+、Mg2+都看作Ca2+,并将其质量折算成CaO的质量,通常把1L水中含有10mgCaO称为1°,1L水中含有20mgCaO即为2°,以此类推,8°以上为硬水,8°以下为软水,Ca2+、Mg2+的硬度之和称为总硬度。用配位滴定法分析某水样(含有Ca2+、Mg2+、Fe3+、Cl-、SO42-、HCO3-)的硬度时,取50.00mL水样放入250mL锥形瓶中,加入稀盐酸数滴,煮沸,冷却,加入2mL1∶1的三乙醇胺溶液和10mLNH3·H2O—NH4Cl缓冲溶液(pH=10)及3滴酸性铬蓝K素酚绿B混合指示剂,用0.01000mol·L-1 EDTA溶液滴定至由红色到蓝色即终点,消耗EDTA溶液12.5mL。另取水样50.00mL,将上述操作中加入缓冲溶液改为加入20%的NaOH溶液使pH>12,用0.01000mol·L-1 EDTA溶液滴定至终点,消耗EDTA溶液7.50mL。(已知Ca2+、Mg2+、Fe3+与EDTA反应的化学计量比均为1∶1)
(1)日常生活中可用____检验某水样是硬水还是软水。
(2)加入数滴稀盐酸并煮沸的目的是______。
(3)加入三乙醇胺溶液的目的是_____。
(4)试计算水样钙硬度和水样总硬度(写出计算过程)。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列五个转化,其中不能通过一步反应实现的是 ( )
①SiO2![]() Na2SiO3②CuSO4
Na2SiO3②CuSO4![]() CuCl2③SiO2
CuCl2③SiO2![]() H2SiO3④CuO
H2SiO3④CuO![]() Cu(OH)2
Cu(OH)2
⑤Na2O2![]() Na2SO4
Na2SO4
A.①②B.③④
C.②③④D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g) ΔH=-565.2 kJ·molˉ1,下列说法不正确的是
A.CO(g)+![]() O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
O2(g)=CO2(g) ΔH=-282.6 kJ·molˉ1
B.2mol CO(g)与1mol O2(g)反应生成2mol CO2(s)放出热量小于565.2 kJ
C.相同条件下,2mol CO(g)和1mol O2(g)的总能量大于2mol CO2(g)的总能量
D.拆开2mol CO和1mol O2的化学键所需总能量低于形成2mol CO2化学键所放出总能量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com