
【题目】碳、氮及其化合物与生活密切相关。请根据要求回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= —574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= —1160kJ/mol
③H2O(g)=H2O(l) △H= —44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式_________。
(2)已知:反应I:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H<0
4NO(g)+6H2O(g) △H<0
反应II:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H<0
2N2(g)+6H2O(g) △H<0
①在恒温恒容装置中充入一定量的NH3和O2,在催化剂的作用下进行反应I,则下列有关叙述中正确的是___(填字母序号)。
A.增大压强,Kp(用压强表示的化学平衡常数)增大
B.若测得容器内3v(NH3)=2v (H2O)时,说明反应已达平衡
C.通入一定量的氮气,则化学反应速率增大
D.达到平衡时体系的压强不再变化
②氨催化氧化时会发生上述两个竞争反应I、II。为分析某催化剂对该反应的选择性,在1L密闭容器中充入1molNH3和2molO2,得有关物质的量关系如图,该催化剂在低温时选择反应_____(填“I”或“II”)。
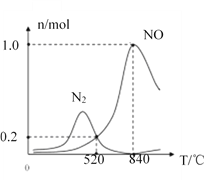
③520℃时,4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式,无需化简)。恒压容器中,为了提高NH3转化为N2平衡转化率的措施有______(填字母序号)
2N2(g)+6H2O(g)的平衡常数K=_______(只需列出数字计算式,无需化简)。恒压容器中,为了提高NH3转化为N2平衡转化率的措施有______(填字母序号)
A.降低反应温度 B. 投料比不变,增加反应物的浓度
C.增大NH3和O2的初始投料比 D. 充入一定量的氦气
(3)己知25℃时HCN和H2CO3的电离常数(Ka.)如下表:
物质 | 电离常数(Ka) |
HCN | Ka=5×10-10 |
H2CO3 | Ka1=4.5×10-7;Ka2=4.7×10-11 |
25℃时,测得等体积等浓度的HCN和NaCN的混合溶液pH=11,则c(Na+)、c(H+)、c(CN—)、c(OH—)、c(HCN)浓度由大到小顺序为______,向NaCN溶液中通入少量CO2,则发生反应的化学方程式为:______________________。
【答案】 CH4(g)+2NO2(g) === N2(g)+CO2(g)+2H2O(l) △H= -955 kJ/mol D II K= ![]() AD c(HCN)>c(Na+)>c(CN—)>c(OH—)>c(H+) NaCN+ CO2+ H2O ===HCN+ NaHCO3
AD c(HCN)>c(Na+)>c(CN—)>c(OH—)>c(H+) NaCN+ CO2+ H2O ===HCN+ NaHCO3
【解析】(1)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= —574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H= —1160kJ/mol
③H2O(g)=H2O(l) △H= —44kJ/mol
根据盖斯定律,由![]() ×①+
×①+![]() ×②+2×③得反应CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(l) △H=
×②+2×③得反应CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(l) △H=![]() ×(—574kJ/mol)+
×(—574kJ/mol)+![]() ×(—1160kJ/mol)+2×(—44kJ/mol)=-955 kJ/mol;(2) ①A.恒容条件下增大压强向气体体积缩小的逆反应方向移动, Kp减小,选项A错误;B.若测得容器内3v(NH3)=2v (H2O)时,没有说明正逆反应速率,无法确定正逆反应速率相等,故不能说明反应已达平衡,选项B错误;C.通入一定量的氮气,对于反应I各反应物的浓度不变,则化学反应速率不变,选项C错误;D.达到平衡时各气体的物质的量不变,体系的压强不再变化,选项D正确。答案选D;②该催化剂在低温时生成的氮气较少,故选择反应II;③NO和N2的平衡浓度是0.2mol/L,NH3的平衡浓度是(1-0.2×3)mol/L=0.4mol/L,O2的平衡浓度是(2-0.2×
×(—1160kJ/mol)+2×(—44kJ/mol)=-955 kJ/mol;(2) ①A.恒容条件下增大压强向气体体积缩小的逆反应方向移动, Kp减小,选项A错误;B.若测得容器内3v(NH3)=2v (H2O)时,没有说明正逆反应速率,无法确定正逆反应速率相等,故不能说明反应已达平衡,选项B错误;C.通入一定量的氮气,对于反应I各反应物的浓度不变,则化学反应速率不变,选项C错误;D.达到平衡时各气体的物质的量不变,体系的压强不再变化,选项D正确。答案选D;②该催化剂在低温时生成的氮气较少,故选择反应II;③NO和N2的平衡浓度是0.2mol/L,NH3的平衡浓度是(1-0.2×3)mol/L=0.4mol/L,O2的平衡浓度是(2-0.2×![]() -1.5×2)mol/L=1.45mol/L,水的平衡浓度是(0.2×1.5+0.2×3)mol/L=0.9mol/L,所以K=
-1.5×2)mol/L=1.45mol/L,水的平衡浓度是(0.2×1.5+0.2×3)mol/L=0.9mol/L,所以K=![]() ;A、该反应△H<0,降低温度平衡右移,转化率提高,选项A正确;B、相当于增大压强,平衡左移,转化率降低,选项B错误;C、增大NH3和O2的初始投料比,氨气的转化率反而降低,选项C错误;D、充入一定量的氦气,恒压条件下,容器体积增大,反应物的分压减小,平衡向气体体积增大的方向移动,转化率增大,选项D正确。答案选AD;(3)25℃时,测得等体积等浓度的HCN和NaCN的混合溶液pH=11,则HCN的电离小于NaCN的水解,c(Na+)、c(H+)、c(CN—)、c(OH—)、c(HCN)浓度由大到小顺序为c(HCN)>c(Na+)>c(CN—)>c(OH—)>c(H+);电离常数越大,则说明该酸酸性越强。由表数据可知,酸性比较:H2CO3 >HCN>HCO3- ,所以根据强酸制弱酸原理,往NaCN溶液中通入少量CO2 发生的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3。
;A、该反应△H<0,降低温度平衡右移,转化率提高,选项A正确;B、相当于增大压强,平衡左移,转化率降低,选项B错误;C、增大NH3和O2的初始投料比,氨气的转化率反而降低,选项C错误;D、充入一定量的氦气,恒压条件下,容器体积增大,反应物的分压减小,平衡向气体体积增大的方向移动,转化率增大,选项D正确。答案选AD;(3)25℃时,测得等体积等浓度的HCN和NaCN的混合溶液pH=11,则HCN的电离小于NaCN的水解,c(Na+)、c(H+)、c(CN—)、c(OH—)、c(HCN)浓度由大到小顺序为c(HCN)>c(Na+)>c(CN—)>c(OH—)>c(H+);电离常数越大,则说明该酸酸性越强。由表数据可知,酸性比较:H2CO3 >HCN>HCO3- ,所以根据强酸制弱酸原理,往NaCN溶液中通入少量CO2 发生的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3。


科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验,能达到实验目的的是
实验装置 |
|
|
|
|
实验目的 | 实验验证浓硫酸具有脱水性、氧化性 | 制取并收集少量氨气 | 验证NaHCO3和Na2CO3的热稳定性 | 采用CCl4萃取I2 |
A | B | C | D |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100mL1.0mol·L-1的NaOH溶液,下列情况不会影响溶液浓度的是
A. 容量瓶使用前有蒸馏水
B. 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C. 俯视确定凹液面与刻度线相切
D. 称量NaOH固体时使用了称量纸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 2g D218O中所含中子数为NA
B. 2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA
C. 1mol/L碳酸氢钠溶液中的HCO3—数目小于NA
D. 一定条件下,39g的乙炔和苯的气体混合物中所含原子总数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取0.1mol/L的NaA和NaB两种盐溶液各1L,分别通入0.02molCO2,发生如下反应:NaA+CO2+H2O=HA+NaHCO3、2NaB+CO2+H2O=2HB+Na2CO3。HA和HB的1L溶液分别加水稀释至体积为VL时可能有如图曲线,则下列说法正确的是
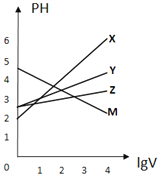
A. 相同条件下,对于c(R-)/[c(HR)·c(OH-)]的值(R代表A或B),一定存在HA>HB
B. 常温下pH:NaA溶液>NaB溶液
C. X是HA,M是HB
D. 若常温下浓度均为0.1mol/L的NaA和HA的溶液等体积混合,则c(A-)+c(HA)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸厂烧渣(主要成分是Fe2O3,其次含少量的SiO2和FeS)经回收处理可制得绿矾(FeSO4·7H2O)和一种重要的水处理剂聚铁胶体[Fe(OH)SO4]n,上述生产工艺流程如下:

请通过分析回答下列相关问题:
(1)操作Ⅰ的名称是 _____。
(2)灼烧产生的尾气对大气有污染,因此工业生产中必须进行回收处理,下列方法可行的是____________。
A.直接用水吸收 B. 用氨水吸收
C. 用浓硫酸吸收 D. 与空气混合用石灰石粉末悬浊液吸收
(3)操作Ⅲ经蒸发浓缩、___________、过滤、____、干燥等。
(4)在由溶液X制聚铁胶体过程中①调节pH及②控制温度目的是_________。
(5)检验溶液X中金属阳离子所加试剂是______,其现象是___________ 。
(6)溶液X转化为溶液Y需加入一种常见物质是 ____________ 。
(7)在反应釜中FeS、O2及稀H2SO4反应生成硫酸铁等物质,则反应的离子方程式是________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态化合物X含C,H,O三种元素,现已知下列条件:①X中C的质量分数;②X中H的质量分数;③X在标准状况下的体积;④X对氢气的相对密度;⑤X的质量,欲确定X的分子式,所需的最少条件是 ( )
A.①③⑤B.②③④C.①②④D.①②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,正确的是( )
A.Mg的摩尔质量为24
B.物质的量的基本单位是摩尔
C.常温常压下,1 mol O2体积为22.4L
D.将1 mol NaCl晶体加入到1L水中,得到NaCl溶液的浓度就是1mol L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com