
【题目】向100mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如图所示.下列判断正确的是( )

A.原NaOH溶液的浓度为0.1mol/L
B.通入CO2的体积为448mL
C.所得溶液的溶质成分的物质的量之比为(NaOH):(Na2CO3)=1:3
D.所得溶液的溶质成分的物质的量之比为(NaHCO3):(Na2CO3)=2:1
【答案】D
【解析】A 根据化学反应,向100mL NaOH溶液中通入一定量的CO2气体,可能发生的反应有:2NaOH+CO2═Na2CO3+H2O或NaOH+CO2═NaHCO3两种可能的情况,再加入盐酸,将Na2CO3或NaHCO3全部反应生成NaCl,根据化学反应中原子守恒,则有n(Na+)=n(Cl﹣),所以n(NaOH)=n(HCl)=0.2mol/L×0.1L=0.02mol,既得c(NaOH)=0.2mol/L,故A错;
B 根据题中的图象,加盐酸25mL是与Na2CO3反应,在加盐酸到100mL是与NaHCO3的反应,设溶液中有Na2CO3 xmol,生成NaHCO3 mmol
Na2CO3 +HCl═NaHCO3+NaCl
1mol 1mol 1mol
x 0.025L×0.2mol/L mmol
解得:x=0.005mol,m=0.005mol
设75mL盐酸反应的NaHCO3的物质的量ymol,生成zmolCO2,则有
NaHCO3+HCl═CO2↑+NaCl
1mol 1mol 1mol
ymol 0.075L×0.2mol/L zmol
解得:y=0.015mol,z=0.015mol
根据原子守恒,加入盐酸恰好完全反应时,共产生CO2 0.015mol,标准状况下的体积为0.336L,故B错;
C所得溶液的溶质成分为Na2CO3、NaHCO3,没有NaOH,故C错误;
D根据题中的图象,加盐酸25mL是与Na2CO3反应,在加盐酸到100mL是与NaHCO3的反应,设溶液中有Na2CO3 xmol,生成 NaHCO3 mmol
Na2CO3+HCl═NaHCO3+NaCl
1mol 1mol 1mol
x 0.025L×0.2mol/L mmol
解得:x=0.005mol,m=0.005mol
设75mL盐酸反应的NaHCO3的物质的量ymol,生成zmolCO2,则有
NaHCO3+HCl═CO2↑+NaCl
1mol 1mol 1mol
ymol 0.075L×0.2mol/L zmol
解得:y=0.015mol,z=0.015mol
求得通入CO2反应后,Na2CO3 、NaHCO3 的物质的量分别为0.005mol、0.01mol,既得
n( NaHCO3 ):n(Na2CO3)=2:1,故D正确.故选:D.


科目:高中化学 来源: 题型:
【题目】维生素C又称“抗坏血酸”,在人体内有重要的功能。例如,能帮助人体将食物中摄取的、不易吸收的Fe3+转变为易吸收的Fe2+,这说明维生素C具有_____________(填“氧化性”或“还原性”),Fe3+有_____________(填“氧化性”或“还原性”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列反应中,水既不作氧化剂,也不作还原剂的氧化还原反应是( )
A. Na2O2+H2O B. Na2O+H2O
C. Na+H2O D. CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除杂的方法中,正确的是
A. 除去乙烷中少量的乙烯:光照下通入Cl2,生成液态CH2Cl-CH2Cl,气液分离
B. 除去甲苯中的苯甲酸:加入NaOH溶液后,静置分液
C. 除去乙酸乙酯中的乙酸:用NaOH溶液中和,然后蒸馏
D. 除去乙醇中少量的水:加入生石灰,然后蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氯水的叙述正确的是( )
A. 新制氯水中只有Cl2分子和H2O分子
B. 光照氯水有气体逸出,该气体是Cl2
C. 氯水在密闭无色玻璃瓶中放置数天后酸性将减弱
D. 新制氯水可以使蓝色石蕊试纸先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,雾霾天气成为我国华北地区乃至全国的环境问题之一。
Ⅰ汽车尾气是空气污染的重要原因。汽车尾气净化原理为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H <0。
2CO2(g)+N2(g) △H <0。
(1)该反应的平衡常数表达式为____________________。
(2)在一恒容的绝热容器(不与外界发生热交换)中模拟上述反应。下面各示意图正确且能说明反应在t1时刻达到平衡状态的是__________。
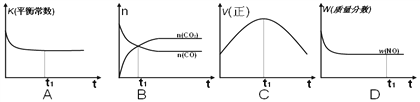
Ⅱ煤燃烧产生的烟气中含有大量硫、氮的氧化物,会引起严重的环境污染问题。
(1) 硫、氮的氧化物都会形成酸雨。为减少酸雨产生,下列措施中不可行的有_______(填序号)。
a.少用煤作燃料 b.把工厂的烟囱加高 c.燃料脱硫
d.燃煤时鼓入足量空气 e.开发新能源
(2)煤燃烧产生的氮的氧化物可以用CH4催化还原。已知:
CH4(g) + 2NO2(g) = N2(g) +CO2(g) + 2H2O(g) △H =-867kJ/mol
2NO2(g) = N2O4(g) △H =-56.9kJ/mol
H2O(l) = H2O(g) △H =+44kJ/mol
写出CH4(g) 还原N2O4(g)生成N2(g) 、CO2(g)和H2O(l)的热化学方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钙(Ca3N2)是一种重要的化学试剂,通常条件下为棕色易水解的固体。某小组在实验室制备氮化钙并测定其纯度,设计如下实脸(夹持装置略去):
I.氮化钙的制备。
(1)加热条件下,钙和氮气制备氮化钙的反应方程式为_________。

(2)按气流由左到右的方向,上述装置合理的连接顺字为__________(填仪器接口字母)。
(3)按连接好的装置进行实验。
①实验步骤如下,检查装置气密性,加入药品:_______(请按正确顺序填入下列步骤的字母标号)。
a.点燃装置C处酒精灯,反应一段时间
b.打开分液漏斗活塞
c.点燃装置A处酒精灯
d.熄灭装置A处酒精灯
e.熄灭装置C处酒精灯
f.关闭分液漏斗活塞
②装置B的作用为_________。
③装置C的硬质玻璃管中的现象为_________。
(4)设计实验证明Ca3N2中混有钙单质:_______________。
II.测定氮化钙纯度。
i.称取4.0g反应后的固体,加入足量水,将生成的气体全部蒸出并通入100.00mL 1 .00mol/L盐酸中,充分反应后,将所得溶液稀释到200 . 00 mL;
ii.取20 . 00mL稀释后的溶液,用0 . 2mol/LNaOH标准溶液滴定过量的盐酸,到终点时消耗标准溶液25 . 00 mL。
(5)所取固体中氮化钙的质量分数为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)红细胞中血红素结构如图所示,回答下列问题:

①Fe2+的轨道表示式[Ar]________。
②所含短周期元素电负性从大到小的顺序是___________。
③羧基中碳原子的杂化轨道方式是______________。
④在肺部,血红素中的Fe2+结合的水分子与氧分子交换,形成氧合血红蛋白,经动脉运送到组织释放出O2;然后血红素结合组织代谢所产生的CO2,经静脉送回肺中与水分子交换,最后将CO2排出体外,完成呼吸过程。血红素中Fe2+与CO2中____原子以____形式结合,这种结合是可逆的,比Fe2+与N的结合弱的原因是______________。
(2)磁性氧化铁Fe3O4含有Fe2+和Fe3+,其晶体属于立方晶系,氧原子呈面心立方密堆积,Fe3+和一半的Fe3+随机占据八面体空穴,电子可在Fe2+、Fe3+间迅速发生转移,另一半Fe3+作阳离占据四面体空穴。Fe3O4是一种盐,其真实结构可较好地表示为_________[Fe2+和Fe3+分别用Fe(II)、Fe(III)表示];该晶体_____导电(填“能”、“不能”);该晶体的密度为5.18g·cm-3,其晶胞中最近的两个氧原子之间的核间距_________cm(列出计算式,不必计算最终结果)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com