
下列关于0.10 mol·L-1 NaHCO3溶液的说法正确的是( )。
A.溶质的电离方程式为NaHCO3=Na++ H++ CO32 -
B.25 ℃时,加水稀释后,n(H+)与n(OH-)的乘积变大
C.离子浓度关系:c(Na+)+c(H+)=c(OH-)+c(HCO3- )+c(CO32 -)
D.温度升高,c(HCO3- )增大
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
已知,有机化合物A只由碳、氢两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平。A、B、C、D、E有如下关系:
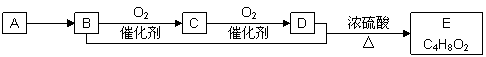
则下列推断不正确的是( )
A.B+D→E的化学方程式为:CH3CH2OH+CH3COOH→CH3COOC2H5
B.D中含有的官能团为羧基,利用D物质可以清除水壶中的水垢
C.物质C的结构简式为CH3CHO,E的名称为乙酸乙酯
D.鉴别A和甲烷可选择使用酸性高锰酸钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
800℃时,在2L密闭容器中发生2NO(g)+O2(g)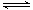 2NO2(g),测得n(NO)随时间的变化如下表:
2NO2(g),测得n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)用O2表示2s时该反应的平均速率v =__________________。
(2)写出该反应的平衡常数表达式:K=__________________________ ___ 。已知:K(800℃)>K(850℃),该反应是__________(填“吸热”或“放热”)反应。
(3)能说明该反应已经达到平衡状态的是___________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=2v正(O2) D.容器内气体的密度保持不变
(4)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是_______。
A.及时分离出NO2气体 B.适当升高温度
C.增大O2的浓度 D.选择高效的催化剂
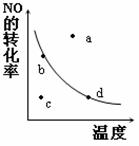
(5)下图中的曲线表示的是其他条件一定时,反应:2NO (g)+O2(g) 2NO2(g)中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 。
2NO2(g)中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是 。
A.a点 B.b点
C.c点 D.d点
查看答案和解析>>
科目:高中化学 来源: 题型:
实验(1)50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
①大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大”、“偏小”、“无影响”)。
②实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒 (填“能”、“不能”)。
③某同学用0.25mol/L的稀硫酸代替盐酸进行上述实验,实验数据如下表
i)请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 |
|
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 |
ii)近似认为0.55 mol/L NaOH溶液和0.25mol/L H2SO4溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=______(保留小数点后一位)。
iii)上述实验结果的数值与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)____。
a.实验装置保温、隔热效果差 b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
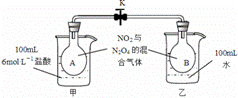 (2)如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放100ml、6 mol /L的HCl溶液,烧杯乙中盛放100ml水,(盐酸和水的起始温度相同)现向烧杯甲的溶液中加入25gNaOH固体,同时向烧杯乙中加入25gNH4NO3固体搅拌使之溶解:
(2)如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放100ml、6 mol /L的HCl溶液,烧杯乙中盛放100ml水,(盐酸和水的起始温度相同)现向烧杯甲的溶液中加入25gNaOH固体,同时向烧杯乙中加入25gNH4NO3固体搅拌使之溶解:
①A烧瓶中气体颜色 ,混合气体的平均分子量 (填“变大”、“变小”、“不变”)。
②B烧瓶中气体颜色 ,理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学用语的描述正确的是( )。
A.氨水显碱性:NH3·H2O === NH4+ + OH-
B.硫酸氢钠溶液显酸性:NaHSO4 === Na+ + H+ + SO42-
C.Na2S溶液显碱性:S2- + 2H2O  H2S + 2OH-
H2S + 2OH-
D.AlCl3溶液显酸性:Al3+ + 3H2O Al(OH)3↓ + 3H+
Al(OH)3↓ + 3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
为了得到比较纯净的物质,使用的方法恰当的是( )。
A.向Na2CO3饱和溶液中,通入过量的CO2后,加热蒸发,再充分灼烧得NaHCO3晶体
B.加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
C.向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D.向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
下表中对应关系正确的是( )。
| A | CH3CH3+Cl2 CH2=CH2+HCl | 均为取代反应 |
| B | 明矾用于净水 碳酸钠溶液显碱性 | 均发生了水解反应 |
| C | Cl2+2Br‾=2Cl‾+Br2 Zn+Cu2+=Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O=4NaOH+O2↑ Cl2+H2O=HCl+HClO | 均为水作还原剂的氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
化学在人类社会发展中起重要的作用,展望未来,化学科学具有十分广阔的探索空间。请你分析下列四个选项中现代化学不涉及的研究领域是( )
A.开发新能源
B.合成新物质
C.空间形式和数量关系
D.防治环境污染
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组用工业上废弃固体(主要成分Cu2S和Fe2O3)混合物制取粗铜和Fe2(SO4)3晶体,设计的操作流程如下:
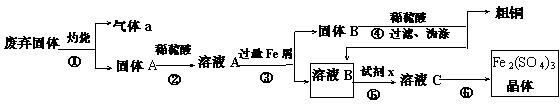

(1)除酒精灯和铁架台或三脚架外,①中所需的容器和夹持仪器分别为 ,①和⑥中都用到的仪器为 ;
(2)试剂x的化学式为 ;x与溶液B反应的离子方程式为 ;
(3)某同学取少量的溶液B向其中加入过量的某种强氧化剂,再滴加KSCN溶液,发现溶液变红色,放置一段时间后,溶液褪色,该同学猜测溶液褪色的原因是溶液中的SCN- 被过量的氧化剂氧化所致。
现给出以下试剂:1.0 mol·L-1 硫酸、1.0 mol·L-1 NaOH溶液、
0.1 mol·L-1 Fe2(SO4)3溶液、20%KSCN溶液、蒸馏水。请你设计合理实验验证乙同学的猜测是否合理。简要说明实验步骤和现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com