
【题目】C5H12的一氯代物有几种( )
A.1B.4C.6D.8
 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:
【题目】将等物质的量的①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2CO3露置于空气中,最后质量变化由小到大的顺序是( )
A. ⑤<④<③<①<② B. ②<①<③<④<⑤ C. ⑤<④<②=③<① D. ⑤<③<④<②<①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~H均为中学化学常见的物质,转化关系如下图。其中A、C均为金属单质,C与水反应生成D和最轻的气体,D、F、G、H的焰色反应均为黄色,E为两性化合物。

(1)写出C与水反应的离子方程式_____________________________________,假设温度不变,该反应会使水的电离程度________(填写“变大”“变小”“不变”)
(2)B的水溶液呈_________性,用离子方程式解释原因______________
(3)将A~H中易溶于水的化合物溶于水,会抑制水的电离的是____________(填序号)
(4)常温下,pH均为10的D、F溶液中,水电离出的c(OH-)之比为___________________向D的稀溶液中通入CO2至溶液呈中性,所得溶液中离子物质的量浓度由大到小的顺序为:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.乙醇室温下在水中的溶解度大于苯酚
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.利用过滤法不能将苯与三溴苯酚的混合物分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)按要求完成下列填空
Ⅰ.已知:①2C3H8(g)+7O2(g)=6CO(g)+8H2O(l) ΔH=-2741.8kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH="-566" kJ/mol
(1)反应C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)的ΔH= ;
(2)C3H8在不足量的氧气里燃烧,生成CO和CO2以及气态水,将所有的产物通入一个固定体积的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g) ΔH>0
CO2(g)+ H2(g) ΔH>0
①下列事实能说明该反应达到平衡的是 ;
a.体系中的压强不发生变化
b.υ正(H2)=υ逆(CO)
c.混合气体的平均相对分子质量不发生变化
d.CO2的浓度不再发生变化
②在某温度下,反应物的起始浓度分别为:c(CO)=" 1" mol·L-1, c(H2O)="2.4" mol·L-1; 达到平衡后,CO的转化率为60%,该反应在此温度下的平衡常数是 ;
(3)熔融碳酸盐燃料电池的电解质为Li2CO3和 Na2CO3的混合物,燃料为CO,在工作过程中,电解质熔融液的组成、浓度都不变,写出负极发生的电极反应式 。
Ⅱ.氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:
SiO2 + C + N2![]() Si3N4 + CO 根据题意完成下列各题:
Si3N4 + CO 根据题意完成下列各题:
(1)配平上述化学反应方程式。 SiO2 + C + N2![]() Si3N4 + CO
Si3N4 + CO
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了30mol氮气,反应生成了5mol一氧化碳,则此时混合气体的平均摩尔质量是 。
(3)氮化硅陶瓷的机械强度高,硬度接近于刚玉(A12O3),热稳定性好,化学性质稳定。以下用途正确的是 。
A.可以在冶金工业上制成坩埚、铝电解槽衬里等设备 |
B.在电子工业上制成耐高温的电的良导体 |
C.研发氮化硅的全陶发动机替代同类型金属发动机 |
D.氮化硅陶瓷的开发受到资源的限制,没有发展前途 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置和相应试剂能达到实验目的的是
选项 | 实验目的 | 试剂a | 试剂b | 试剂c | 装置 |
A | 验证非金属性:N>C>Si | 稀硝酸 | Na2CO3 | Na2SiO3溶液 |
|
B | 验证氧化性:Cl2>Br2 | 浓盐酸 | KMnO4 | FeBr2溶液 | |
C | 验证SO2有还原性 | 浓硫酸 | Na2SO3 | KMnO4溶液 | |
D | 除去Na2SO3中的Na2SO4 | 氯水 | 混合物 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2的含量是衡量大气污染的一个重要指标,工业上常采用催化还原法或吸收法处理SO2。利用催化还原SO2不仅可消除SO2污染,而且可得到有经济价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。
己知CH4和S的燃烧热(△H)分别为-890.3 kJ /mol和-297.2 kJ /mol,则CH4和SO2反应的热化学方程式为 _________________________________________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:
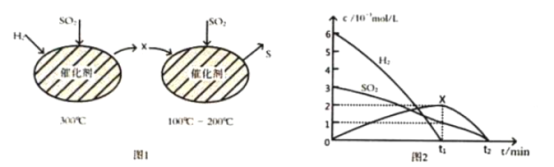
①分析可知X为________(写化学式), 0~t1时间段的温度为_____, 0~t1时间段用SO2表示的化学反应速率为 ___________________________。
②总反应的化学方程式为__________________________________________________________。
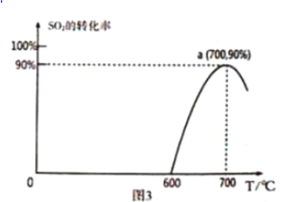
(3)焦炭催化还原SO2生成S2,化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
S2(g)+2CO2(g),恒容容器中,1 mol/LSO2与足量的焦炭反应,SO2的转化率随温度的变化如图3所示。
①该反应的△H _________________________ 0 (填“>”或“<”)
②计算700℃该反应的平衡常数为____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水反应生成一种氯化物和两种氮化物。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

①制备NO发生装置可以选用___________________(填写字母代号),请写出发生反应的离子方程式:___________________。
②欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a→ __________________(按气流方向,用小写字母表示)。
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:


①实验室也可用X装置制备NO,X装置的优点为________________________________。
②检验装置气密性并装入药品,打开K2,然后再打开 ____________,通入一段时间气体,其目的为___________________________,然后进行其他操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中NOCl可能发生反应的化学方程式为________________________。
④若尾气处理装置连接上图烧杯中导管d,则烧杯中可加入 __________溶液。
(3)取Z中所得液体mg溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用cmolL-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。则亚硝酰氯(NOC1)的质量分数为________(用代数式表示)。
[已知:Ag2CrO4为砖红色固体;Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从精炼钢的阳极泥中(主要成分为Cu2Te)回收碲的工艺流程如下:

请回答下列问题:
(1)“焙烧”后,碲主要以TeO2形式存在,则每生成32gTeO2,反应转移电子的物质的量为____________mol。
(2)为选择最佳焙烧工艺,进行温度和硫酸加入量的条件试验,结果如下表所示:

则实验中应选择的条件为________________________。
(3)“氧化”时的溶液温度不宜过高,原因为________________________。
(4)工艺(I)中,“还原”时发生的总离子方程式为______________________________。H2SO4和Na2SO3可用浓盐酸代替,但缺点为______________________________________。
(5)工艺(II)中,“浸出液电积”时产生碲粉的电极反应式为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com