
【题目】某烃不能使溴水褪色,0.1 mol 该烃完全燃烧时生成0.6mol二氧化碳和5.4g水,请通过计算回答下列问题:
(1)该烃的分子式___________,结构简式为________。
(2)根据下列条件写出有关反应的化学方程式:
①该烃在浓硫酸催化下与浓硝酸的反应:_____。
②该烃在催化剂作用下与H2的反应:_________。
【答案】C6H6 ![]()
![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O ![]() +3H2
+3H2![]()
![]()
【解析】
可假设烃的分子式为CxHy,然后利用燃烧反应方程式,建立已知与未知的关系式,从而求出x与y,由性质及分子式,可确定有机物的结构,从而推出该有机物具有的性质。
(1)设烃的分子式为CxHy,则燃烧的化学方程式为CxHy+(x+![]() )O2
)O2![]() xCO2+
xCO2+![]() H2O,
H2O,
从而得出x=![]() =6,y=
=6,y=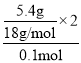 =6,该烃的分子式为C6H6。由于该烃不能使溴水褪色,所以不属于烯烃或炔烃,且分子结构对称,从而得出其结构简式为
=6,该烃的分子式为C6H6。由于该烃不能使溴水褪色,所以不属于烯烃或炔烃,且分子结构对称,从而得出其结构简式为![]() 。答案为:C6H6;
。答案为:C6H6;![]() ;
;
(2)①![]() 在浓硫酸催化下与浓硝酸的反应,生成
在浓硫酸催化下与浓硝酸的反应,生成![]() 和H2O,化学方程式为:
和H2O,化学方程式为:![]() +HNO3
+HNO3![]()
![]() +H2O。答案为:
+H2O。答案为:![]() +HNO3
+HNO3![]()
![]() +H2O;
+H2O;
②![]() 在催化剂作用下与H2反应生成
在催化剂作用下与H2反应生成![]() ,反应的化学方程式为:
,反应的化学方程式为:![]() +3H2
+3H2![]()
![]() 。答案为:
。答案为:![]() +3H2
+3H2![]()
![]() 。
。


 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】海水提镁的主要流程如下,下列说法正确的是

①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A. ①②③④⑤ B. ②③ C. ④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用实验1验证FeCl3与Cu的反应,观察到有白色沉淀产生,决定对其进行深入探究。
实验1:
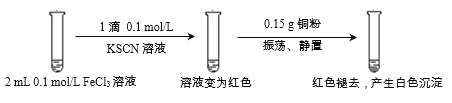
资料:
i. CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO42-、Cu2+与Cl-。
ii. SCN-被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与卤素单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为__________________。
(2)下列由实验1得到的推论中,合理的是_______________(填字母序号)。
a. Cu能还原Fe3+
b. Fe3+与SCN-的反应是可逆反应
c. 白色沉淀中的Cu(I)(I表示+1价铜元素)可能是由Fe3+氧化Cu得到的
(3)为探究实验1中白色沉淀的成分,小组同学实施了实验2:
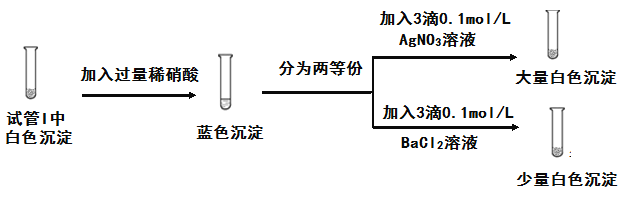
由实验2可知,实验1中白色沉淀的成分是____。
(4)该小组欲进一步探究实验1中白色沉淀产生的原因,实施了实验3:
步骤 | 实验操作 | 实验现象 |
I | 溶液变为蓝色,澄清透明,底部只有少量红色固体剩余 | |
II | 取I中上层清液于试管中,滴加1滴 0.1mol/L KSCN溶液 | 立刻出现红色,同时有白色沉淀生成 |
III | 振荡II中试管,静置 | 白色沉淀变多,红色逐渐褪去 |
①步骤I的实验操作是_____________________。
②根据实验3的现象,小组同学认为Fe3+与Cu反应的氧化产物不含Cu(I),他们的判断依据是______。
③步骤II中加入KSCN溶液后出现红色的可能原因是________________。
④解释步骤III中实验现象产生的可能原因:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验测得,某有机物相对分子质量为72。
(1)若该有机物是烃,其分子式为__________。它有______种同分异构体。若该烃与![]() 发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为___________________。
发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为___________________。
(2)若该有机物分子中只有一个氧原子,其分子式为_____________________。
(3)若该有机物![]() 完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为___________。
完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是

A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。回答下列问题:
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H1=-362 kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为__________________。
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为_______。(已知H2CO3 的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
(3)在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS 的脱硫。该反应的化学方程式为_______。
(4)COS的水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
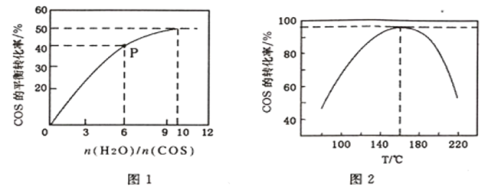
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]__________,温度__________。
②P点对应的平衡常数为_____________ 。(保留小数点后2 位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应Zn+H2SO4=ZnSO4+H2↑,1 mol Zn反应时放出Q kJ热量。下列叙述不正确的是( )
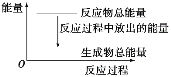
A.反应过程中的能量关系可用如图表示B.滴入少许CuSO4溶液后反应速率减小
C.若将该反应设计成原电池,则锌为负极D.理论上当转移4 mol电子时放出2QkJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Cu(NO3)2的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制 AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示): 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行二氧化硫制备与性质实验的组合装置(如图),部分固定装置未画出。
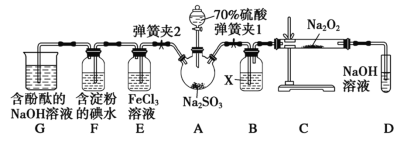
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是___,再往D中装水,然后微热A,观察到D中有气泡冒出,移开酒精灯,D中导气管中有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置B中试剂X是___,它的作用是___。
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是___。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为___,发生反应的离子方程式是___。
(5)E中溶液由棕黄色变为浅绿色,写出发生反应的离子方程式。___
(6)G中含酚酞的NaOH溶液逐渐褪色,欲证明褪色的原因是SO2具有漂白性还是SO2溶于水显酸性。请设计实验___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com