
【题目】对于反应Zn+H2SO4=ZnSO4+H2↑,1 mol Zn反应时放出Q kJ热量。下列叙述不正确的是( )
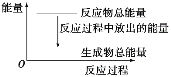
A.反应过程中的能量关系可用如图表示B.滴入少许CuSO4溶液后反应速率减小
C.若将该反应设计成原电池,则锌为负极D.理论上当转移4 mol电子时放出2QkJ热量
科目:高中化学 来源: 题型:
【题目】甲醇制烯烃(MTO)是煤制烯烃工艺路线的核心技术。煤制烯烃主要包括煤的气化、液化、烯烃化三个阶段。
(1)煤的液化发生的主要反应之一为2H2(g)+CO(g)=CH3OH (g) ΔH=a kJ·mol1,在不同温度下,K(500℃)=2.5 L2·mol2,K(700℃)=0.2 L2·mol2。
①ΔH________0(填“>”、“<”、“=”)。
②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH3OH物质的量分别为2 mol、1 mol、3mol,则此时生成CH3OH的速率____消耗CH3OH的速率(填“>”、“<”、“=”)。
(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
i 2CH3OH(g)=C2H4(g)+2H2O(g) ΔH1=-20.9 kJ·mol1
ii3CH3OH(g)=C3H6(g)+3H2O(g) ΔH2=-98.1 kJ·mol1
iii 4CH3OH(g)=C4H8(g)+4H2O(g) ΔH3=-118.1 kJ·mol1
①C3H6转化为C2H4的热化学方程式为iv:2C3H6(g)![]() 3C2H4 (g) ΔH4=____。
3C2H4 (g) ΔH4=____。
②加入N2作为稀释剂,反应i中C2H4的产率将_____(增大、减小、不变)。
(3)为研究不同条件对反应的影响,测得不同温度下平衡时C2H4、C3H6和C4H8的物质的量分数变化,如图所示:
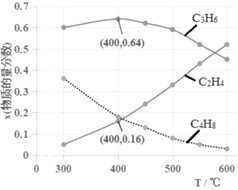
①随着温度的升高,C3H6的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是_____________________________;当温度低于400℃时,原因是________________________。
②体系总压为0.1MPa,400℃时反应iv的平衡常数Kp=________(列式计算,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③为了获得更高的C2H4在产物中的比例,除控制较高温度的条件外,以下较适宜的是______。
A.增加水醇比 B.降低水醇比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定环境中,下列各组离子一定大量共存的是
A. 甲基橙呈红色的溶液中:K+、Na+、S2-、AlO2-
B. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C. 常温下,在![]() = 1×1012的溶液中:NH4+、CO32-、K+、Cl-
= 1×1012的溶液中:NH4+、CO32-、K+、Cl-
D. 常温下,水电离出的c(OH—)=1×10—13 mol/L的溶液中:Na+、NH4+、HCO3-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃不能使溴水褪色,0.1 mol 该烃完全燃烧时生成0.6mol二氧化碳和5.4g水,请通过计算回答下列问题:
(1)该烃的分子式___________,结构简式为________。
(2)根据下列条件写出有关反应的化学方程式:
①该烃在浓硫酸催化下与浓硝酸的反应:_____。
②该烃在催化剂作用下与H2的反应:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列溶液中微粒的物质的量浓度关系正确的是
A. 新制氯水中:c(H+)=c(HClO)+2c(ClO-)+c(OH-)
B. pH=8的NaClO2溶液中:c(Na+)>c(ClO2-)>c(OH-)>c(H+)
C. 0.1mol·L-1HCl溶液与0.2 mol·L-1 NH3·H2O溶液等体积混合pH>7:c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)
D. 0.1mol·L-1K2C2O4溶液与0.2 mol·L-1KHC2O4溶液等体积混合:4c(K+)=3[c(C2O42-)+c(HC2O4-)+c(H2C2O4) ]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
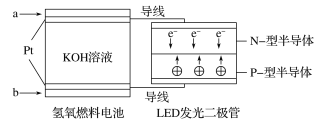
A.a处通入氧气,b处通入氢气
B.通入H2的电极发生反应:H2-2e-=2H+
C.通入O2的电极为电池的正极
D.该装置将化学能最终转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO=3H++6H2O+(CH2)6N4H+[(滴定时,1 mol (CH2)6N4H+与1 mol H+相当)],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500 g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇
匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。
按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积______(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察__________________________。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时的现象为_______________________________________________。
⑤滴定结束时俯视滴定管读数,则测得样品中氮的质量分数_____(填“偏高”、“偏低”或“无影响”)。
⑵滴定结果如下表所示:
滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
滴定前的刻度/mL | 滴定后的刻度/mL | ||
1 | 25.OO | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.2 | 25.02 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数是多少?_____(写出解题过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:
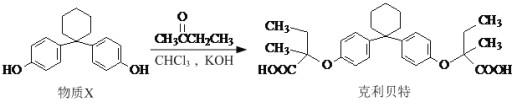
下列有关叙述正确的是
A. 克利贝特的分子式为C28H34O6
B. B.物质X分子中所有碳原子可能位于同一平面内
C. 用NaOH溶液可以鉴别物质X和克利贝特
D. 物质X中无手性碳原子,克利贝特中有两个手性碳原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1molNa2O2所含的离子总数是0.4NA
B.0.1mol的11B中,含有0.6NA个中子
C.常温常压下,124gP4中所含P—P键数目为4NA
D.密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com