
【题目】甲醇制烯烃(MTO)是煤制烯烃工艺路线的核心技术。煤制烯烃主要包括煤的气化、液化、烯烃化三个阶段。
(1)煤的液化发生的主要反应之一为2H2(g)+CO(g)=CH3OH (g) ΔH=a kJ·mol1,在不同温度下,K(500℃)=2.5 L2·mol2,K(700℃)=0.2 L2·mol2。
①ΔH________0(填“>”、“<”、“=”)。
②若反应在容积为2L的密闭容器中进行,500℃测得某一时刻体系内H2、CO、CH3OH物质的量分别为2 mol、1 mol、3mol,则此时生成CH3OH的速率____消耗CH3OH的速率(填“>”、“<”、“=”)。
(2)通过研究外界条件对反应的影响,尽可能提高甲醇生成乙烯或丙烯的产率。
甲醇制烯烃的主要反应有:
i 2CH3OH(g)=C2H4(g)+2H2O(g) ΔH1=-20.9 kJ·mol1
ii3CH3OH(g)=C3H6(g)+3H2O(g) ΔH2=-98.1 kJ·mol1
iii 4CH3OH(g)=C4H8(g)+4H2O(g) ΔH3=-118.1 kJ·mol1
①C3H6转化为C2H4的热化学方程式为iv:2C3H6(g)![]() 3C2H4 (g) ΔH4=____。
3C2H4 (g) ΔH4=____。
②加入N2作为稀释剂,反应i中C2H4的产率将_____(增大、减小、不变)。
(3)为研究不同条件对反应的影响,测得不同温度下平衡时C2H4、C3H6和C4H8的物质的量分数变化,如图所示:
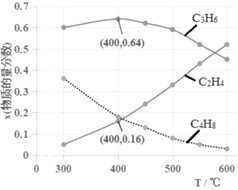
①随着温度的升高,C3H6的物质的量分数呈现先增大后减小的趋势。温度高于400℃时,原因是_____________________________;当温度低于400℃时,原因是________________________。
②体系总压为0.1MPa,400℃时反应iv的平衡常数Kp=________(列式计算,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③为了获得更高的C2H4在产物中的比例,除控制较高温度的条件外,以下较适宜的是______。
A.增加水醇比 B.降低水醇比
【答案】< < +133.5 kJ·mol-1 增大 温度高于400℃时,温度升高,反应iv:2C3H6(g)![]() 3C2H4 (g) ΔH4=+133.5 kJ·mol-1向正反应方向移动,C3H6的物质的量分数减小 当温度低于400℃时,CH3OH转化为C4H8的物质的量分数随温度升高而迅速减小,而转化为C2H4的物质的量分数增大的幅度小于C4H8的减小幅度,因而CH3OH转化C3H6的物质的量分数随温度升高而增大 0.001MPa A
3C2H4 (g) ΔH4=+133.5 kJ·mol-1向正反应方向移动,C3H6的物质的量分数减小 当温度低于400℃时,CH3OH转化为C4H8的物质的量分数随温度升高而迅速减小,而转化为C2H4的物质的量分数增大的幅度小于C4H8的减小幅度,因而CH3OH转化C3H6的物质的量分数随温度升高而增大 0.001MPa A
【解析】
(1)①在不同温度下,K(500℃)=2.5L·mol1,K(700℃)=0.2L·mol1,K(700℃)<K(500℃),说明温度升高有利于向逆反应方向移动,可得ΔH<0。
②500℃时,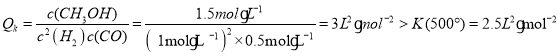 ,此时反应向逆反应方向进行,生成CH3OH的速率小于消耗CH3OH的速率。
,此时反应向逆反应方向进行,生成CH3OH的速率小于消耗CH3OH的速率。
(2)①依据热化学方程式和盖斯定律计算i×3-ii×2得到iv:2C3H6(g)= 3C2H4(g)ΔH4=+133.5 kJ·mol-1。
②加入N2作为稀释剂,使体系的体积增大,相当于压强减小,有利于向正反应方向移动,C2H4的产率增大。
(3)①温度高于400℃时,温度升高,反应iv:2C3H6(g)![]() 3C2H4(g)ΔH4=+133.5 kJ·mol-1向正反应方向移动,C3H6的物质的量分数减小;当温度低于400℃时,CH3OH转化为C4H8的物质的量分数随温度升高而迅速减小,而转化为C2H4的物质的量分数增大的幅度小于C4H8的减小幅度,因而CH3OH转化C3H6的物质的量分数随温度升高而增大。
3C2H4(g)ΔH4=+133.5 kJ·mol-1向正反应方向移动,C3H6的物质的量分数减小;当温度低于400℃时,CH3OH转化为C4H8的物质的量分数随温度升高而迅速减小,而转化为C2H4的物质的量分数增大的幅度小于C4H8的减小幅度,因而CH3OH转化C3H6的物质的量分数随温度升高而增大。
②分压=总压×物质的量分数,因此400℃时,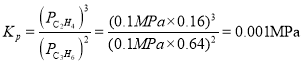
③结合图像,温度升高可以提高C2H4的物质的量分数,B正确;对于i、ii和iii来说,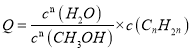 ,当n值越大,增大水醇比时,反应逆向进行趋势越大,副产物越少,即C3H6、C4H8就越少,A正确。
,当n值越大,增大水醇比时,反应逆向进行趋势越大,副产物越少,即C3H6、C4H8就越少,A正确。


 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】选做(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。根据下图回答下列问题:
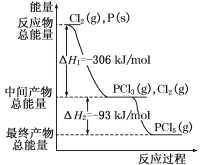
(a)P和Cl2反应生成PCl3的热化学方程式是______________________________ ;
(b)P和Cl2分两步反应生成1 mol PCl5的ΔH3=____________________,P和Cl2一步反应生成1 mol PCl5的ΔH4____________ΔH3(填“大于”.“小于”.或“等于”)。
(2)在微生物作用的条件下,NH经过两步反应被氧化成NO。这两步的能量变化示意图如下:

(a)第二步反应是________反应(选填“放热”或“吸热”),判断依据是__________ 。
(b)1molNH4+(aq)全部氧化成NO2-(aq)的热化学方程式是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是形成光化学烟雾和酸雨的重要原因。人们研究了诸多有关氮氧化物的性质,请回答下列问题:
(1)处理 NOx的一种方法是利用甲烷催化还原NOx。
CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g) K1
CH4 (g)+2NO2(g) = N2 (g)+CO2(g)+2H2O(g) K2
CH4 (g)+4NO(g) = 2N2 (g)+CO2(g)+2H2O(g) K3
K1、K2、K3依次为三个反应的平衡常数,则K3=______(用K1、K2表示)
(2)在恒容密闭容器中通入等物质的量的CO和NO,在一定条件下发生反应:2CO(g)+2NO(g)![]() N2(g)+2CO2 (g),测得NO的平衡转化率与温度及压强的关系如图所示:
N2(g)+2CO2 (g),测得NO的平衡转化率与温度及压强的关系如图所示:
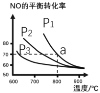
①则该反应的△H ________0(填“﹤”“﹥”或“=”)。
②对于气相反应,用某组分(B)的平衡分压强 p(B)代替物质的量浓度 c(B) 也可表示平衡常数kp,则该反应的平衡常数表达式kp=________,如果p1 =1.65MPa,求a点的平衡常数kp =_________(MPa)1 (结果保留 3 位有效数字,分压=总压×物质的量分数)。
③为探究速率与浓度的关系,该实验中,根据相关实验数据,粗略绘制了2条速率—浓度关系曲线: v正~c(NO)和v逆~c(CO2 )
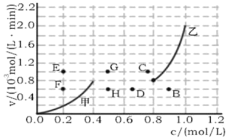
则:与曲线 v正~c(NO)相对应的是图中曲线________(填“甲”或“乙”)。当降低反应体系的温度,反应一段时间后,重新达到平衡,v正和v逆相应的平衡点分别为______(填字母)。
(3)利用电化学原理,将NO2、O2和熔融的KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72的废水,如图所示;电解过程中溶液发生反应:Cr2O72+6Fe2++14H+=2Cr3++6Fe3+ +7H2O。
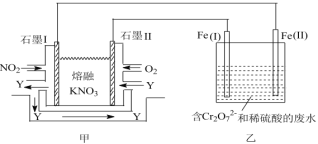
①甲电池工作时,Y是气体,可循环使用。则石墨I附近发生的电极反应式为________。乙池中的pH________(填“变大”“变小”或“不变”)。
②工作时,在相同条件下,甲池内消耗的O2和NO2的体积_____。
(4)已知H3PO4为三元酸,Ka1=7.0×103mol·L1,Ka2=6.2×108 mol·L1,Ka3=4.5×1013mol·L 1。则 Na2HPO4水溶液呈________(填“酸”、“中”、“碱”)性,用Ka与Kh的相对大小,说明判断理由________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提镁的主要流程如下,下列说法正确的是

①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A. ①②③④⑤ B. ②③ C. ④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上由黄铜矿(主要成分为 CuFeS2)冶炼铜的主要流程如下。下列说法不正确的是
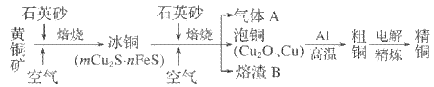
A. 气体A中的大气污染物可用氨水吸收并回收利用
B. 由泡铜冶炼粗铜的化学方程式为3Cu2O+2Al ![]() Al2O3+6Cu
Al2O3+6Cu
C. 加入石英砂作为添加剂熔剂,生成更稳定、更容易分离的硅酸盐
D. 用过量稀H2SO4可全部溶解熔渣B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯的结构简式可用![]() 来表示,下列关于苯的叙述中正确的是
来表示,下列关于苯的叙述中正确的是
A. 苯主要是以石油为原料而获得的一种重要化工原料
B. 苯中含有碳碳双键,所以苯属于烯烃
C. 苯分子中6个碳碳化学键完全相同
D. 苯可以与溴水、高锰酸钾溶液反应而使它们褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,体积为2 L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)![]() N2O4(g)(无色),如图所示。
N2O4(g)(无色),如图所示。

(1)曲线________(填“X”或“Y”)表示N2O4的物质的量随时间的变化曲线。
(2)3 min内,以X的浓度变化表示的平均反应速率为_____________。
(3)下列措施能使该反应速率加快的是________(用序号回答)。
①升高温度 ②减小容器体积 ③通入N2O4 ④通入Ar使压强增大 ⑤通入HCl气体
(4)下列叙述能说明该反应已达到化学平衡状态的是____________(填标号)。
A.容器内压强不再发生变化
B.混合气体的密度不变
C.容器内混合气体原子总数不变
D.混合气体的平均相对分子质量不变
E.v(NO2)=2v(N2O4)
F.相同时间内消耗n mol的Y的同时消耗2n mol的X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用实验1验证FeCl3与Cu的反应,观察到有白色沉淀产生,决定对其进行深入探究。
实验1:
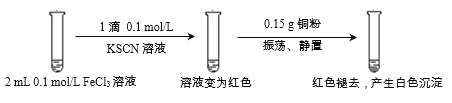
资料:
i. CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO42-、Cu2+与Cl-。
ii. SCN-被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与卤素单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为__________________。
(2)下列由实验1得到的推论中,合理的是_______________(填字母序号)。
a. Cu能还原Fe3+
b. Fe3+与SCN-的反应是可逆反应
c. 白色沉淀中的Cu(I)(I表示+1价铜元素)可能是由Fe3+氧化Cu得到的
(3)为探究实验1中白色沉淀的成分,小组同学实施了实验2:
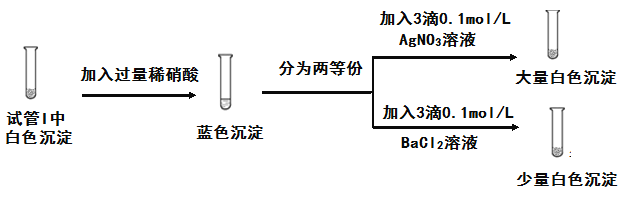
由实验2可知,实验1中白色沉淀的成分是____。
(4)该小组欲进一步探究实验1中白色沉淀产生的原因,实施了实验3:
步骤 | 实验操作 | 实验现象 |
I | 溶液变为蓝色,澄清透明,底部只有少量红色固体剩余 | |
II | 取I中上层清液于试管中,滴加1滴 0.1mol/L KSCN溶液 | 立刻出现红色,同时有白色沉淀生成 |
III | 振荡II中试管,静置 | 白色沉淀变多,红色逐渐褪去 |
①步骤I的实验操作是_____________________。
②根据实验3的现象,小组同学认为Fe3+与Cu反应的氧化产物不含Cu(I),他们的判断依据是______。
③步骤II中加入KSCN溶液后出现红色的可能原因是________________。
④解释步骤III中实验现象产生的可能原因:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应Zn+H2SO4=ZnSO4+H2↑,1 mol Zn反应时放出Q kJ热量。下列叙述不正确的是( )
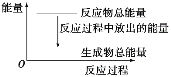
A.反应过程中的能量关系可用如图表示B.滴入少许CuSO4溶液后反应速率减小
C.若将该反应设计成原电池,则锌为负极D.理论上当转移4 mol电子时放出2QkJ热量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com