
【题目】在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,则这个碳原子被称为“手性碳原子”,新型纤维酸类降脂药克利贝特可由物质X在一定条件下反应制得:
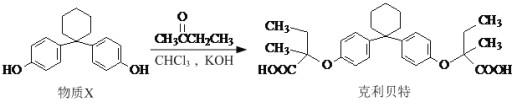
下列有关叙述正确的是
A. 克利贝特的分子式为C28H34O6
B. B.物质X分子中所有碳原子可能位于同一平面内
C. 用NaOH溶液可以鉴别物质X和克利贝特
D. 物质X中无手性碳原子,克利贝特中有两个手性碳原子
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
【题目】某小组用实验1验证FeCl3与Cu的反应,观察到有白色沉淀产生,决定对其进行深入探究。
实验1:
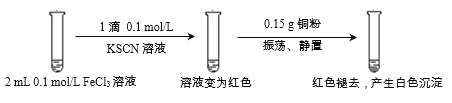
资料:
i. CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO42-、Cu2+与Cl-。
ii. SCN-被称为拟卤素离子,性质与卤素离子相似;(SCN)2性质与卤素单质相似,其水溶液呈黄色。
(1)FeCl3溶液与KSCN溶液反应的离子方程式为__________________。
(2)下列由实验1得到的推论中,合理的是_______________(填字母序号)。
a. Cu能还原Fe3+
b. Fe3+与SCN-的反应是可逆反应
c. 白色沉淀中的Cu(I)(I表示+1价铜元素)可能是由Fe3+氧化Cu得到的
(3)为探究实验1中白色沉淀的成分,小组同学实施了实验2:
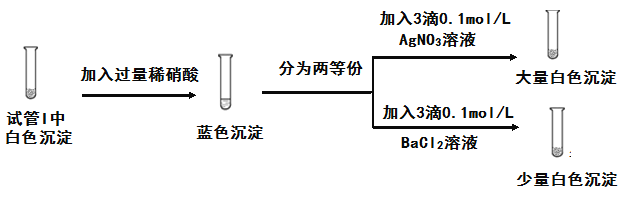
由实验2可知,实验1中白色沉淀的成分是____。
(4)该小组欲进一步探究实验1中白色沉淀产生的原因,实施了实验3:
步骤 | 实验操作 | 实验现象 |
I | 溶液变为蓝色,澄清透明,底部只有少量红色固体剩余 | |
II | 取I中上层清液于试管中,滴加1滴 0.1mol/L KSCN溶液 | 立刻出现红色,同时有白色沉淀生成 |
III | 振荡II中试管,静置 | 白色沉淀变多,红色逐渐褪去 |
①步骤I的实验操作是_____________________。
②根据实验3的现象,小组同学认为Fe3+与Cu反应的氧化产物不含Cu(I),他们的判断依据是______。
③步骤II中加入KSCN溶液后出现红色的可能原因是________________。
④解释步骤III中实验现象产生的可能原因:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应Zn+H2SO4=ZnSO4+H2↑,1 mol Zn反应时放出Q kJ热量。下列叙述不正确的是( )
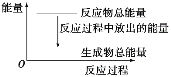
A.反应过程中的能量关系可用如图表示B.滴入少许CuSO4溶液后反应速率减小
C.若将该反应设计成原电池,则锌为负极D.理论上当转移4 mol电子时放出2QkJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Cu(NO3)2的水溶液呈 (填“酸”、“中”、“碱”)性,常温时的pH 7(填“>”、“=”、“<”),原因是(用离子方程式表示): ;实验室在配制 AgNO3的溶液时,常将AgNO3固体先溶于较浓的硝酸中,然后再用蒸馏水稀释到所需的浓度,以 (填“促进”、“抑制”)其水解。
(2)氯化铝水溶液呈 性,原因是(用离子方程式表示): 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是 。
(3)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是( )
①盐卤(含MgCl2)![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液
MgCl2溶液![]() 无水MgCl2
无水MgCl2
②铝土矿![]() AlO2-
AlO2-![]() Al(OH)3
Al(OH)3![]() Al2O3
Al2O3
③NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
④NaCl溶液![]() Cl2
Cl2![]() 无水FeCl2
无水FeCl2
⑤S![]() SO3
SO3![]() H2SO4
H2SO4
⑥SiO2![]() Na2SiO3溶液
Na2SiO3溶液![]() H2SiO3
H2SiO3
A. ③⑥B. ③⑤⑥C. ①④⑤D. ①③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示

下列说法正确的悬
A. △H1<0,△H2>0
B. 反应①②③的反应热满足关系:△H2-△H1=△H3
C. 反应①②③的平衡常数满足关系;K1·K2=K3
D. 要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2L甲醛气体与xL的氧气混合点燃,反应后甲醛和氧气均无剩余,生成的混合气体的体积为aL(气体体积均在120°C,101kPa时测定),并将此aL混合气体通过足量的碱石灰后,测得剩余气体的体积为bL。若a-b=3.5,则x的值为
A. 2B. 4C. 1.75D. 3.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行二氧化硫制备与性质实验的组合装置(如图),部分固定装置未画出。
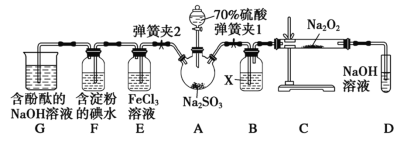
(1)在组装好装置后,若要检验A~D装置的气密性,其操作是___,再往D中装水,然后微热A,观察到D中有气泡冒出,移开酒精灯,D中导气管中有水柱形成且高度保持不变,说明装置气密性良好。
(2)装置B中试剂X是___,它的作用是___。
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是___。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F、G中,能说明I-还原性弱于SO2的现象为___,发生反应的离子方程式是___。
(5)E中溶液由棕黄色变为浅绿色,写出发生反应的离子方程式。___
(6)G中含酚酞的NaOH溶液逐渐褪色,欲证明褪色的原因是SO2具有漂白性还是SO2溶于水显酸性。请设计实验___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu2O可用于制作船底防污漆,某学习小组探究制备Cu2O的方法。
(查阅资料)① CuSO4与Na2SO3溶液混合可制备Cu2O。② Cu2O为砖红色固体;酸性条件下生成Cu2+和Cu。
③ Cu2O和Cu(SO3)23-可以相互转化 Cu2O![]() Cu(SO3)23-(无色)
Cu(SO3)23-(无色)
(1)配制0.25 mol·L-1CuSO4溶液和0.25 mol·L-1 Na2SO3溶液。测得CuSO4溶液pH=4,Na2SO3溶液pH=9。用离子方程式表示CuSO4溶液pH=4的原因_______。
(2)完成CuSO4溶液和Na2SO3溶液反应制Cu2O的离子方程式: ____Cu2++ ____SO32-+ ____ =____Cu2O↓+ ____ + ____HSO3-
(实验探究)
操作 | 现象 |
| i 有黄色沉淀出现,随着 Na2SO3溶液的滴入,沉淀增加,当加到5 mL时,溶液的蓝色消失。 ii 将试管加热,黄色沉淀变为砖红色,有刺激性气味气体产生。 iii在加热条件下,继续滴入Na2SO3溶液,砖红色沉淀减少,当1加到10 mL时,沉淀完全溶解,得无色溶液。 |
(3)证明ii中砖红色沉淀是Cu2O的实验方案是_______。
(4)经检验i中黄色沉淀含有Cu2SO3,ii中沉淀由黄色变砖红色的化学方程式是______。
(5)iii中砖红色沉淀消失的原因是_______。
(6)在加热条件下,若向2 mL 0.25 mol·L-1Na2SO3溶液中滴加0.25 mol·L-1CuSO4溶液至过量,预期观察到的现象是_______。
(7)由上述实验得出结论:CuSO4溶液和Na2SO3溶液反应制备Cu2O,应控制的条件是_______、_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com