
| A、三氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ |
| B、4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ |
| C、在Mn2+溶液中加入HNO3再加入PbO2得紫红色溶液:5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O |
| D、将0.1mol/L Na2CO3溶液数滴缓缓滴入O.1mol/L 25mL盐酸中2H++CO32-=CO2↑+H2O |


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:
| A、③>②>① |
| B、②>①>③ |
| C、①>②>③ |
| D、③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 碱 | 盐 | 酸性氧化物 | 电解质 | |
| A | H2SO4 | Na2CO3 | CaCO3 | CO2 | Cu |
| B | NaHSO4 | NaOH | NH4Cl | SO2 | BaSO4 |
| C | CH3COOH | NaOH | CaF2 | CO | SO3 |
| D | HNO3 | KOH | NaHCO3 | SO3 | NaCl |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中不可能含有共价键 |
| B、两种不同种元素原子形成的共价键一定是非极性共价键 |
| C、共价化合物中不可能含有离子键 |
| D、非金属元素形成的化合物中不可能含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同分异构现象的广泛存在是造成有机物种类繁多的唯一原因 |
| B、乙烷在光照下与氯气反应生成的一氯代烃只有一种 |
| C、分子式为CH4O和C2H6O的物质一定互为同系物 |
| D、有机物结构中碳原子通过单键连接,剩余价键均与氢原子结合都属于烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
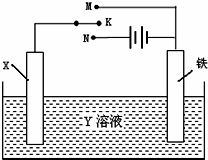
| A、若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极阴极保护法 |
| B、若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,这种方法称为外加电流阴极保护法 |
| C、若X为铜棒,Y为硫酸铜溶液,开关K置于M处时,铁电极上的电极反应式为Cu2++2e→Cu |
| D、若X为铜棒,Y为硫酸铜溶液,开关K置于N处时,溶液中各离子浓度都不会发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com