
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
 ,故答案为:第三周期第ⅢA族;HClO4;
,故答案为:第三周期第ⅢA族;HClO4; ;
;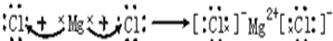 ,H、E形成原子个数比为1:1的化合物是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在一对共用电子,所以过氧化钠的电子式为
,H、E形成原子个数比为1:1的化合物是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子和O原子之间存在一对共用电子,所以过氧化钠的电子式为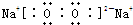 ,含有的化学键为离子键和非极性键;
,含有的化学键为离子键和非极性键; ,
,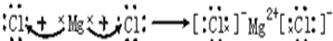 ;
;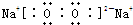 ;离子键和非极性键;
;离子键和非极性键; ;
;
| ||
| ||


科目:高中化学 来源: 题型:
| A、三氯化铝溶液中加入过量氨水:Al3++4NH3?H2O=AlO2-+2H2O+4NH4+ |
| B、4mol/L的NaAlO2溶液和7mol/L的HCl等体积互相均匀混合:4AlO2-+7H++H2O=3Al(OH)3↓+Al3+ |
| C、在Mn2+溶液中加入HNO3再加入PbO2得紫红色溶液:5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O |
| D、将0.1mol/L Na2CO3溶液数滴缓缓滴入O.1mol/L 25mL盐酸中2H++CO32-=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
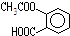 ,它可以发生的反应类型有( )
,它可以发生的反应类型有( )| A、只有①②④⑤ |
| B、只有①②④⑤⑥ |
| C、只有①②④⑤⑥⑦ |
| D、只有①②④⑤⑥⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
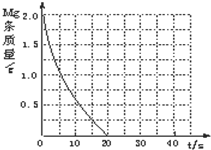 某实验小组为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
某实验小组为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.| 实验编号 | 温度(K) | 盐酸浓度(mol?L-1) | 醋酸浓度(mol?L-1) | 实验目的 |
| ① | 298 | 0.20 | 无 | a.实验①和②是探究 b.实验①和③是探究 c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. |
| ② | 308 | 0.20 | 无 | |
| ③ | 298 | 0.40 | 无 | |
| ④ | 无 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
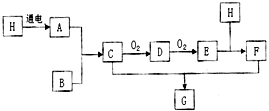 已知图中H是常见无色液体,B是空气中含量最多的物质,A和B要在高温高压才能合成C,F是一种强酸:
已知图中H是常见无色液体,B是空气中含量最多的物质,A和B要在高温高压才能合成C,F是一种强酸:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| T/K | 273 | 323 | 373 |
| K | 0.005 | 0.022 | 0.36 |
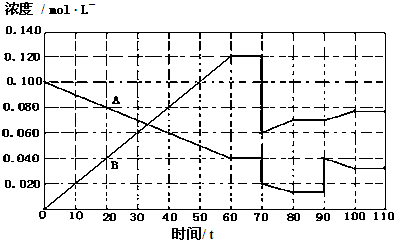
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com