
| 20mL×1mol/L |
| 50mL |
| m |
| M |
| 20mL×1mol/L |
| 50mL |
| 1.28g |
| 64g/mol |
| 1 |
| 2 |
| 0.896L |
| 22.4L/mol |
| 1 |
| 3 |
| 0.11L×2mol/L |
| 0.2L |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、同分异构现象的广泛存在是造成有机物种类繁多的唯一原因 |
| B、乙烷在光照下与氯气反应生成的一氯代烃只有一种 |
| C、分子式为CH4O和C2H6O的物质一定互为同系物 |
| D、有机物结构中碳原子通过单键连接,剩余价键均与氢原子结合都属于烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
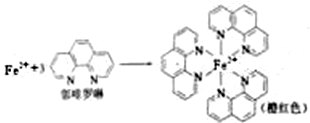 已知:
已知:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要0.2mol/L CuSO4溶液250mL,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4?5H2O) ②4mol/L CuSO4溶液
实验室需要0.2mol/L CuSO4溶液250mL,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4?5H2O) ②4mol/L CuSO4溶液查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
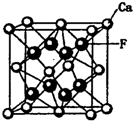 碳、氮、氧、氟都是位于第二周期的重要的非金属元素.请回答下列问题:
碳、氮、氧、氟都是位于第二周期的重要的非金属元素.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com