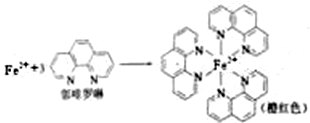
已知:
(1)测定土壤中铁的含量时需先将三价铁还原为二价铁,再采用邻啡罗啉作显色剂,用比色法测定,若土壤中含有高氯酸盐时会对测定有干扰.相关的反应如下:
4FeCl
3+2NH
2OH?HCl═4FeCl
2+N
2O↑+6HCl+H
2O
①Fe
2+在基态时,价层电子排布式
.
②羟胺(NH
2OH)中N原子的杂化方式
.
③Fe
2+与邻啡罗啉形成的配合物中,配位数为
.
(2)硫酸铜晶体的化学式也可以表达为Cu(H
2O)
4SO
4?H
2O晶体,该晶体中含有的化学键类型是
.
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、磷化镓及铜锢硒薄膜电池等.其中元素P、As、Se第一电离能由小到大的顺序为:
.
(4)①有机太阳能固体电池材料含有高纯度C
60,其结构如图1,则1mol C
60分子中π键的数目为
,C
60的晶胞结构如图2,则其配位数为
若此晶胞的密度为ρ g/cm
3则两个最近C
60间的距离为
cm(列式表达,已知阿伏伽德罗常数为N
A)
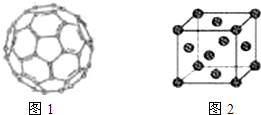
②如果把晶胞顶点与最近三个面心所围成的空隙叫做四面体空隙,第四周期电负性最小的原子可作为容体掺入C
60晶体的空隙中,形成具有良好的超导性的掺杂C
60化合物.若每个四面体空隙填入一个原子,则全部填满C
60晶体的四面体空隙后,所形成的掺杂C
60化合物的化学式为
.

 已知:
已知:
 在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个k原子,1+6×
在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个k原子,1+6× 在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×
在面心立方结构中,每个小立方体对应1个四面体空隙,一共有8个正四面体空隙,上图画出了其中一个,第四周期电负性最小的原子是K,所以晶胞中一共有8个K原子,1+6×

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案 某实验小组为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
某实验小组为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K. 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.