
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| △c |
| △t |
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
| ||
| 10min |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
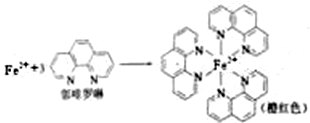 已知:
已知:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要0.2mol/L CuSO4溶液250mL,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4?5H2O) ②4mol/L CuSO4溶液
实验室需要0.2mol/L CuSO4溶液250mL,实验室可提供配制溶液的试剂有:①蓝色胆矾晶体(CuSO4?5H2O) ②4mol/L CuSO4溶液查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
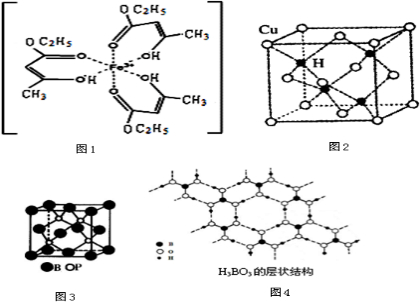
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
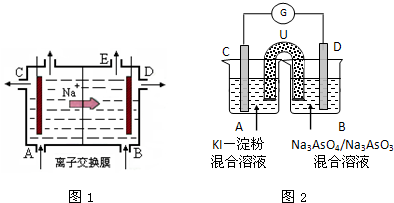
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢氧化钠固体 |
| B、硝酸钠溶液 |
| C、硫酸钾溶液 |
| D、碳酸钠固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com