
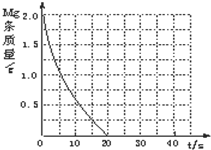
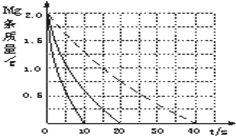
 某实验小组为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
某实验小组为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.| 实验编号 | 温度(K) | 盐酸浓度(mol?L-1) | 醋酸浓度(mol?L-1) | 实验目的 |
| ① | 298 | 0.20 | 无 | a.实验①和②是探究 b.实验①和③是探究 c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. |
| ② | 308 | 0.20 | 无 | |
| ③ | 298 | 0.40 | 无 | |
| ④ | 无 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
 ,
, .
.


科目:高中化学 来源: 题型:
| 酸 | 碱 | 盐 | 酸性氧化物 | 电解质 | |
| A | H2SO4 | Na2CO3 | CaCO3 | CO2 | Cu |
| B | NaHSO4 | NaOH | NH4Cl | SO2 | BaSO4 |
| C | CH3COOH | NaOH | CaF2 | CO | SO3 |
| D | HNO3 | KOH | NaHCO3 | SO3 | NaCl |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
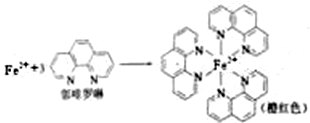 已知:
已知:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
1 |
分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是① ④溶液 |
略 |
2 |
向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 | ②中无明显现象 ③中红色明显变浅 |
滴加③时反应的化学方程式: |
| 3 | 测定CH3COOH溶液 与H2CO3溶液的酸性 |
略 |
CH3COOH溶液的酸性远大于H2CO3溶液 |
| 4 | 将CO2通入C6H5ONa溶液中 | 反应的化学方程式: | |
| 结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号) | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com