
| T/K | 273 | 323 | 373 |
| K | 0.005 | 0.022 | 0.36 |
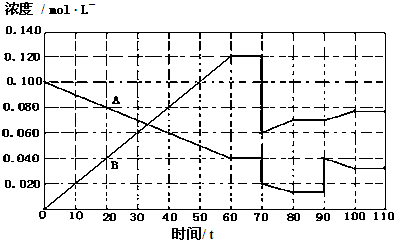
| c2(B) |
| c(A) |
| c2(B) |
| c(A) |


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | -1 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
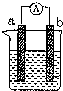 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
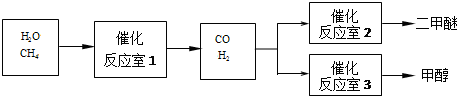
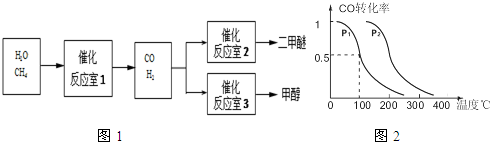
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
1 |
分别取4种溶液,滴加紫色石蕊溶液 | 溶液变红的是① ④溶液 |
略 |
2 |
向含酚酞的NaOH溶液中,各滴加等量的②③两种溶液 | ②中无明显现象 ③中红色明显变浅 |
滴加③时反应的化学方程式: |
| 3 | 测定CH3COOH溶液 与H2CO3溶液的酸性 |
略 |
CH3COOH溶液的酸性远大于H2CO3溶液 |
| 4 | 将CO2通入C6H5ONa溶液中 | 反应的化学方程式: | |
| 结论:4种物质的羟基中的氢原子的活泼性由强到弱的顺序是(填序号) | |||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2L SO2和2L CO2 |
| B、0.5mol水和标准状况下11.2L CO2 |
| C、标准状况下1mol氧气和22.4L水 |
| D、0.2mol硫化氢气体和2.24 L氯化氢气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com