
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
相关数据如下:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡过程体系的能量变化 | |||
CO | H2O | CO2 | H2O | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 容器①中CO反应速率等于H2O的反应速率
D. 平衡时,两容器中CO2的浓度相等
【答案】D
【解析】A.平衡时放出的热量为32.8 kJ,故参加反应的CO的物质的量![]() CO的转化率为
CO的转化率为![]() ,故A正确;B、容器①②温度相同,平衡常数相同,根据容器①计算平衡常数,由A计算可知,平衡时CO的物质的量变化量为0.8mol,
,故A正确;B、容器①②温度相同,平衡常数相同,根据容器①计算平衡常数,由A计算可知,平衡时CO的物质的量变化量为0.8mol,
则:CO(g)+H2O(g)CO2(g)+H2(g)
开始(mol):1 4 00
变化(mol):0.8 0.8 0.8 0.8
平衡(mol):0.2 3.2 0.8 0.8
故平衡常数K=![]() =1
=1
故容器②中的平衡常数为1,令容器②中CO2的物质的量变化量为amol,则:
CO2(g)+H2(g)CO(g)+H2O(g)
开始(mol):1 4 00
变化(mol):a a a a
平衡(mol):1-a4-aa a
所以![]() ,解得a=0.8。
,解得a=0.8。
计算可知CO2的转化率为![]() ,故B正确;
,故B正确;
C、速率之比等于化学计量数之比,故容器①中CO反应速率等于H2O的反应速率,故C正确;D、结合B选项的计算,由A中计算可知容器①平衡时CO2的物质的量为0.8mol,容器②中CO2的物质的量为1mol-0.8mol=0.2mol,容器的体积相同,平衡时,两容器中CO2的浓度不相等,故D错误;故选D。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】下列有关离子检验的说法正确的是
A. 加入稀盐酸产生无色气体,气体能使澄清石灰水变浑浊,原溶液中一定含有CO![]()
B. 加入稀盐酸无明显现象,再加入硝酸银溶液产生白色沉淀,原溶液中一定含有Cl―
C. 加入BaCl2溶液产生白色沉淀,再加入稀盐酸沉淀不溶解,原溶液中一定含有SO![]()
D. 加入KSCN溶液,呈现血红色,原溶液中一定含有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用含三价钒(V2O3)为主的某石煤为原料(含有Al2O3、CaO等杂质),钙化法焙烧制备V2O5,其流程如下:
![]()
【资料】:+5价钒在溶液中的主要存在形式与溶液pH的关系:
pH | 4~6 | 6~8 | 8~10 | 10~12 |
主要离子 | VO2+ | VO3 | V2O74 | VO43 |
(1)焙烧:向石煤中加生石灰焙烧,将V2O3转化为Ca(VO3)2的化学方程式是______。
(2)酸浸: ① Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是______。
② 酸度对钒和铝的溶解量的影响如图所示:酸浸时溶液的酸度控制在大约3.2%,根据如图推测,酸浸时不选择更高酸度的原因是______。

(3)转沉:将浸出液中的钒转化为NH4VO3固体,其流程如下:
![]()
① 浸出液中加入石灰乳的作用是______。
② 已知CaCO3的溶解度小于Ca3(VO4)2。向Ca3(VO4)2沉淀中加入(NH4)2CO3溶液,可使钒从沉淀中溶出。结合化学用语,用平衡移动原理解释其原因:______。
③ 向(NH4)3VO4溶液中加入NH4Cl溶液,控制溶液的pH=7.5。当pH>8时,NH4VO3的产量明显降低,原因是______。
(4)测定产品中V2O5的纯度:
称取a g产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1 mL c1 mol·L1 (NH4)2Fe(SO4)2溶液(VO2+ + 2H+ + Fe2+ == VO2+ + Fe3+ + H2O)。最后用c2 mol·L1 KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2 mL。已知 MnO4被还原为Mn2+,假设杂质不参与反应。则产品中V2O5的质量分数是______。(V2O5的摩尔质量:182 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车净化的主要原理为2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g) △H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
2CO2(g)+N2(g) △H<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是
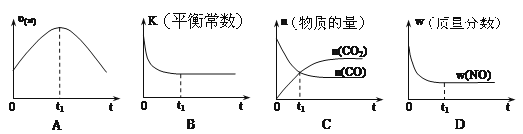
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在金属Pt、Cu和铱(Ir)的催化作用下,密闭容器中的H2可高效转化酸性溶液中的硝态氮(NO3)以达到消除污染的目的。其工作原理的示意图如下:

下列说法不正确的是
A. Ir的表面发生反应:H2 + N2O == N2 + H2O
B. 导电基体上的负极反应:H2-2e == 2H+
C. 若导电基体上只有单原子铜,也能消除含氮污染物
D. 若导电基体上的Pt颗粒增多,不利于降低溶液中的含氮量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)滤渣a中除含泥沙外,一定含有____,分离溶液a和滤渣a的操作需要的玻璃仪器为__________________。
(2)溶液a中含铝元素的溶质与过量试剂A反应的离子方程式为_______________,溶液a与过量试剂A反应生成滤渣b的离子方程式为__________________。
(3)溶液b与过量试剂B反应生成滤渣c的离子方程式为_______________________。
(4)加热滤渣c得到氧化铝的操作需要使用的仪器除了酒精灯、三角架、泥三角,还有________(填主要仪器名称),实验室里还常往NaAlO2溶液中通入过量的_______来制取A1(OH)3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洁厕灵和84消毒液混合使用会发生反应:![]() ,生成有毒的氯气。
,生成有毒的氯气。![]() 代表阿伏加德罗常数的值,下列说法正确的是
代表阿伏加德罗常数的值,下列说法正确的是
A. 每生成1mol氯气,转移的电子数为![]()
B. 1molNaCl含有的电子数为![]()
C. Cl2只作还原产物
D. 标准状况下,将![]() 溶解在
溶解在![]() 水中,形成
水中,形成![]() 的盐酸
的盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是VA族元素,砷及其化合物被应用于农药和合金中。回答下列问题:
(1)基态砷原子的电子排布式为___________________,第四周期元素中,第一电离能低于砷原子的p区元素有____________ (填元素符号)。
(2)氮原子间能形成氮氮叁键,而砷原子间不易形成叁键的原因是____________。
(3)AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°,AsH3分子键角较小的原因是____________。
(4)亚砷酸(H3AsO3)分子中,中心原子砷的VSEPR模型是____________,砷原子杂化方式为____________。
(5)砷化镍的晶胞如图。晶胞参数a=360.2pm, c=500.9pm, γ=120°。

①镍原子配位数为____________,配原子构成的几何体是____________。
②该晶体密度的计算式为____________g·cm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com