
【题目】砷(As)是VA族元素,砷及其化合物被应用于农药和合金中。回答下列问题:
(1)基态砷原子的电子排布式为___________________,第四周期元素中,第一电离能低于砷原子的p区元素有____________ (填元素符号)。
(2)氮原子间能形成氮氮叁键,而砷原子间不易形成叁键的原因是____________。
(3)AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°,AsH3分子键角较小的原因是____________。
(4)亚砷酸(H3AsO3)分子中,中心原子砷的VSEPR模型是____________,砷原子杂化方式为____________。
(5)砷化镍的晶胞如图。晶胞参数a=360.2pm, c=500.9pm, γ=120°。

①镍原子配位数为____________,配原子构成的几何体是____________。
②该晶体密度的计算式为____________g·cm-3。
【答案】 [Ar]3d104s24p3 Ga、Ge、Se 砷原子半径较大,原子间形成的σ键较长,p-p轨道肩并肩重叠程度较小或几乎不能重叠,难以形成π键 砷原子电负性小于氮原子,其共用电子对离砷核距离较远,斥力较小,键角较小 四面体形 sp3杂化 6 正八面体 ![]()
【解析】(1)砷原子核电荷数33,基态的电子排布式为[Ar]3d104s24p3;同一周期,从左到右,第一电离能呈现增大的趋势,第VA族元素P为半充满状态,第一电离能大于邻近元素的第一电离能;因此第四周期元素中,第一电离能低于砷原子的p区元素有Ga、Ge、Se ;正确答案:[Ar]3d104s24p3 ; Ga、Ge、Se。
(2)由于砷原子半径较大,原子间形成的σ键较长,p-p轨道肩并肩重叠程度较小或几乎不能重叠,难以形成π键,所以氮原子间能形成氮氮叁键,而砷原子间不易形成叁键;正确答案:砷原子半径较大,原子间形成的σ键较长,p-p轨道肩并肩重叠程度较小或几乎不能重叠,难以形成π键。
(3)AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°;AsH3分子键角较小的原因是砷原子电负性小于氮原子,其共用电子对离砷核距离较远,斥力较小,键角较小;正确答案:砷原子电负性小于氮原子,其共用电子对离砷核距离较远,斥力较小,键角较小。
(4)亚砷酸(H3AsO3)分子结构式为![]() ,砷原子的价层电子对数为4,属于sp3杂化,中心原子砷的VSEPR模型是四面体形;正确答案:四面体形; sp3杂化。
,砷原子的价层电子对数为4,属于sp3杂化,中心原子砷的VSEPR模型是四面体形;正确答案:四面体形; sp3杂化。
(5)根据砷化镍的晶胞的结构 可以看出,镍原子配位数为6,6个砷原子形成正八面体;正确答案:6;正八面体。
可以看出,镍原子配位数为6,6个砷原子形成正八面体;正确答案:6;正八面体。
②根据砷化镍的晶胞可知:含有的镍原子个数8×1/8+4×1/4=2,含有砷原子个数为2,所以该晶胞中含有2个砷化镍,该晶胞的质量为2×134/NA g,根据晶胞的俯视图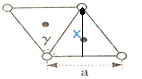 ,可以求出x=
,可以求出x=![]() a pm=
a pm=![]() ×10-10 cm;该晶胞的体积为
×10-10 cm;该晶胞的体积为![]() ×10-10×360.2×10-10×500.9×10-10 cm3;根据ρ=m/V=
×10-10×360.2×10-10×500.9×10-10 cm3;根据ρ=m/V=![]() ;正确答案:
;正确答案:![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
CO2(g)+H2(g) ΔH=-41 kJ·mol-1。相同温度下,在体积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。
相关数据如下:
容器 编号 | 起始时各物质的物质的量/mol | 达平衡过程体系的能量变化 | |||
CO | H2O | CO2 | H2O | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8 kJ |
② | 0 | 0 | 1 | 4 | 热量变化:Q |
下列说法中,不正确的是( )
A. 容器①中反应达平衡时,CO的转化率为80%
B. 容器①中CO的转化率等于容器②中CO2的转化率
C. 容器①中CO反应速率等于H2O的反应速率
D. 平衡时,两容器中CO2的浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且甲、乙、丙均为10电子的分子,Y、Z结合生成化合物丁。有关物质的转化关系如下图所示,下列说法错误的是( )

A. 原子序数由小到大的顺序是:W<Z<Y<X
B. 化合物的沸点由高到低的顺序是:乙>甲>丙
C. Z的最高价氧化物对应的水化物一定为强酸
D. Y与W、Z都能形成两种或两种以上的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物体内某些有机物的元素组成可表示如下:

(1)A的功能的多样性是由A的_________的多样性决定的。字母A3代表的物质的名称是_________,产生A2 过程涉及的单层膜的细胞器有__________、_________。
(2)c的名称为______,C1的名称为_______; 人体内C彻底水解得到的产物有_________种。
(3)B是主要的能源物质,则b______________。
(4)A是由a经_______反应形成的,形成的化学键的结构简式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】链烃A是重要的有机化工原料,由A经以下反应可制备一种有机玻璃:

已知:羰基化合物可发生以下反应:

(注:R'可以是烃基,也可以是H原子)
回答下列问题:
(1)A分子中官能团的结构简式为____________,分子结构鉴定时,获取官能团信息的仪器是____________。
(2)B生成C的反应类型为____________。
(3)核磁共振氢谱表明D只有一种化学环境的氢,D的结构简式为_________,分子中最多有_______个原子共平面。
(4)E发生酯化、脱水反应生成F的化学方程式为_____________________________。
(5)F的同分异构体中能同时满足下列条件的共有____________种(不含立体异构)。
①能与饱和NaHCO3溶液反应产生气体②能使Br2的四氯化碳溶液褪色
其中核磁共振氢谱显示为3组峰,且峰面积比为6∶1∶1的结构简式为____________。
(6)聚丙烯酸钠(![]() )是一种高吸水性树脂。参考上述信息,设计由乙醇制备该高聚物单体的合成线路。_______________________________________________________
)是一种高吸水性树脂。参考上述信息,设计由乙醇制备该高聚物单体的合成线路。_______________________________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com