
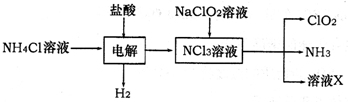
| ||
| . |
| ||
| . |
| 1 |
| 6 |
| 1 |
| 6 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��c��Z��=0.75mol?L-1 | B��c��Z��=1.20mol?L-1 |
| C��c��W��=0.80mol?L-1 | D��c��W��=1.00mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��0.1mol?L-1 | B��0.2mol?L-1 |
| C��0.05mol?L-1 | D��0.15mol?L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��-82kJ/mol | B��-41kJ/mol | C��-312kJ/mol | D��+82kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ��ʴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 ��H=һ1411 kJ/mol
��H=һ1411 kJ/mol ��H=һ2600 kI/mol
��H=һ2600 kI/mol| A�����ʵ�ȼ����Խ�����¶�Խ�� |
| B����ͬ�����µ������ϩ����Ȳ��ȫȼ��ʱ����Ȳ���Ƚ��� |
| C��25�桢101 kPaʱ��1 mol��ϩ��ȫȼ��������̬����ʱ���ų�������С��1411 kJ |
| D����Ȳ��ȼ����Ϊ1300 kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2B(g)+C(g) ��H��0����ƽ��ʱ��Ҫʹv���������͡�c(A)����Ӧ��ȡ�Ĵ�ʩ��
2B(g)+C(g) ��H��0����ƽ��ʱ��Ҫʹv���������͡�c(A)����Ӧ��ȡ�Ĵ�ʩ���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com