
����Ŀ�������£���0.1000 mol/ L NaOH ��Һ�ֱ�ζ�20.00 mL 0.1000 mol/L HCl��Һ��20.00 mL 0.1000 mol/LCH3COOH��Һ���õ�2 ���ζ����ߣ�����ͼ��ʾ:

��1����A��C���жϣ��ζ�HCl��Һ��������_____(����ͼ1������ͼ2��)��
��2��a=____ mL��
��3��c(Na+ )=c(CH3COO-)�ĵ���_________��
��4��E���Ӧ����Ũ���ɴ�С��˳��Ϊ___________________________��
��5����NaOH ��Һ�ζ�CH3COOH ��Һ�����У�NaOH��Һ������10.00 mLʱ�����ʱ���Һ��c(CH3COOH)____c (CH3COO-)(��>������<������=�� )��
��6����25�� ʱ����c mol/L�Ĵ�����Һ��0.2mol/LNaOH��Һ�������Ϻ���Һǡ�������ԣ��ú�c �Ĵ���ʽ��ʾCH3COOH �ĵ��볣��Ka=___________��
���𰸡� ͼ1 20.00 D c(Na��)>c(CH3COO��)>c(OH��)>c(H��) �� ![]()
����������1�����⿼��һԪǿ����һԪ����ıȽϣ�HCl����ǿ�ᣬ0.1mol��L��1��HCl��Һ��pH=1��CH3COOH�����ᣬ0.1mol��L��1��CH3COOH��Һ��pH>1������ͼ�����㣬ͼ1Ϊ�ζ�HCl�����ߣ�ͼ2Ϊ�ζ�CH3COOH�����ߣ���2�����⿼���кͷ�Ӧ��������ǡ����ȫ��Ӧʱ����Һ��pH=7��������NaOH�����Ϊ20.00mL����3����������Ũ�ȴ�С�ȱȽϣ����ݵ���غ㣬c(Na��)��c(H��)=c(CH3COO��)��c(OH��)����Ϊc(Na��)=c(CH3COO��)����c(H��)=c(OH��)��D�����Ҫ��4�����⿼������Ũ�ȴ�С�Ƚϣ����ݣ�2����E���������������ǡ����ȫ��Ӧ������ΪCH3COONa������Ũ�ȴ�С˳����c(Na��)>c(CH3COO��)>c(OH��)>c(H��)����5�����⿼������Ũ�ȴ�С�Ƚϣ�NaOH��Һ����10.00mL����ʱ��Һ������ΪCH3COOH��CH3COONa���������ʵ�����ȣ�����ͼ�������������Ƶ����Ϊ10.00mLʱ����Һ�����ԣ�˵��CH3COOH�ĵ���̶ȴ���CH3COO����ˮ��̶ȣ���c(CH3COOH)<c(CH3COO��)����6�����⿼�����ƽ�ⳣ���ļ��㣬���ݵ���غ㣬c(Na��)��c(H��)=c(CH3COO��)��c(OH��)������Ϊc(Na��)=c(CH3COO��)��c(CH3COO��)=0.2/2mol/l=0.1mol/l��c(CH3COOH)=(c/2��0.1)mol��L��1����Һǡ��Ϊ���ԣ�c(H��)=10��7mol��L��1������ƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬��K= 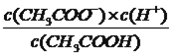 =
= 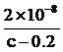 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��д�����Ba2+��OH����Cl������Һ�У������ܴ�������������ǣ�������
A.CO32��
B.NO3��
C.H+
D.Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʱ��淽��������ǣ�( )
A.�����������ֽ⣬������������ɫ�Լ�ƿ��
B.̼������Һ�ʼ��ԣ��Լ�ƿƿ��һ�������������ò�����
C.����ˮ��������ʿ��Է��ڳ�ʪ�谵��
D.��ѧ�е���ȼ�ױ���ҪԶ���Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���20.00mL0.1000molL��1�İ�ˮ����μ���0.1000molL��1�����ᣬpH����������ı仯��ͼ��ʾ��������NH3���ݳ���������˵������ȷ���ǣ�������

A. ��Ӧ�����У�c��NH4+��+c��H+��=c��OH����+c��Cl����
B. V��HCl��=10.00mLʱ��c��NH4+����c��Cl������c��NH3H2O��
C. V��HCl����20.00mLʱ����Һһ���ʼ���
D. V��HCl��=30.00mLʱ��2c��Cl����=3c��NH4+��+3c��NH3H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ȼ����ǻ�ѧ�ϳ��еij������ʣ����Ȼ������������ڸ������ܱ����������������������ܱ�H2O2����ΪCr(��)�������Ȼ������������£�

��1���ظ���立ֽ������������������Cr2O3������ˮ����������ˮϴ�ӵ�ԭ��__________������ж�����ϴ�Ӹɾ�_______��
��2����֪CCl4�е�Ϊ57.6�棬Ϊ��֤�ȶ���CCl4���������˵ļ��ȷ�ʽ��________��
��3������ͼװ���Ʊ�CrCl3ʱ����Ҫ����������ٽ������ռ����������У��ڼ��ȷ�Ӧ����400�棬��ʼ��������ƿ��ͨ�뵪����ʹCCl4�������������뷴Ӧ�ҽ��з�Ӧ���������µ�650�棻��������ƿ��װ��150mLCCl4��������CCl4���¶ȿ�����50��60��֮�䣻�ܷ�Ӧ�ܳ��ڶ˳�����CrCl3������ʱ���жϼ��ȹ�ʽ¯�ĵ�Դ����ֹͣ����CCl4������ͨ�뵪�������װ�������ԡ���ȷ��˳��Ϊ���ޡ��ۡ�__________��

��4����֪��Ӧ���з�������Ҫ��Ӧ�У�Cr2O3 + 3CCl4 �� 2CrCl3 + 3COCl2��������綾��ʵ������ͨ����н��У������Ҵ�����COCl2������һ�ֺ���������C5H10O3�������Ҵ�����β���Ļ�ѧ����ʽΪ__________________________��
��5����Ʒ�����Ȼ������������IJⶨ
��ȡ��Ʒ0.3300g����ˮ�ܽⲢ������250mL����ƿ�С���ȡ25.00mL�ڵ���ƿ(һ�ִ�������ƿ)�У��������������1gNa2O2���������������ʵ�ϡ�ͣ�Ȼ����������2mol/LH2SO4����Һ��ǿ���ԣ���ʱ����Cr2O![]() ���ڣ��ټ���1.1gKI��������ҡ�ȣ��ڰ�������5���Ӻ���1mLָʾ������0.0250mol/L�����������Һ�ζ����յ㣬ƽ�вⶨ���Σ�ƽ�����ı������������Һ24.00mL����֪��Cr2O
���ڣ��ټ���1.1gKI��������ҡ�ȣ��ڰ�������5���Ӻ���1mLָʾ������0.0250mol/L�����������Һ�ζ����յ㣬ƽ�вⶨ���Σ�ƽ�����ı������������Һ24.00mL����֪��Cr2O![]() +6I��+14H+=2Cr3++3I2+7H2O��2Na2S2O3+I2===Na2S4O6+2NaI��
+6I��+14H+=2Cr3++3I2+7H2O��2Na2S2O3+I2===Na2S4O6+2NaI��
�ٸ�ʵ���ѡ�õ�ָʾ������Ϊ____________��
���������ƿ��CrCl3��Һ�������У�����Na2O2��ҲҪ������У�����Ҫԭ����____��
����Ʒ����ˮ���Ȼ�������������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦC(s)+H2O(g)![]() CO(g)+H2(g)���ܱ������н��У����������ĸı���䷴Ӧ���ʼ�����Ӱ�����
CO(g)+H2(g)���ܱ������н��У����������ĸı���䷴Ӧ���ʼ�����Ӱ�����
������ ������C���� �۽������������Сһ��ܱ���������䣬����Heʹ��ϵѹǿ���� �ݱ���ѹǿ���䣬����He ʹ����������
A. �٢� B. �ڢ� C. �٢� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʾ���ʱ仯�Ļ�ѧ�����У�����ȷ����
A. ���������绯ѧ��ʴ�ĸ����缫��Ӧ:Fe-2e-=Fe2+
B. HS- �ĵ��뷽��ʽ:HS-+H2O![]() S2-+H3O+
S2-+H3O+
C. HCO3-��ˮ�ⷽ��ʽ:HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
D. AlCl3��Һ��Na2CO3��Һ��Ӧ�����ӷ���ʽ:2A13++3CO32-=Al2(CO3)3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪25��ʱ�����ᡢ̼�ᡢ������ĵ���ƽ�ⳣ�����±�:(��λʡ��)
���� | ̼�� | ������ |
Ka=1.7��10-5 | Ka1=4.2��10-7 Ka2=5.6��10-11 | Ka=6.2��10-10 |
(1)д��̼��ĵ�һ�����뷽��ʽ___________��
(2)25��ʱ����Ũ�ȵ�������Һ��NaCN ��Һ����Na2CO3��Һ����CH3COONa ��Һ��pH�ɴ�С��˳��Ϊ_______(�����)��
(3)25��ʱ����NaCN��Һ��ͨ������CO2����Ӧ�����ӷ���ʽΪ___________��
(4)��Ũ��Ϊ0.02mol/L��HCN ��0.01mol/LNaOH ��Һ�������ϣ���û����Һ��c(Na+)>c(CN-)�����й�ϵ��ȷ����_______��
a.c(H+)-) b.c(H+)+c(HCN)=c(OH-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25��ʱ��Ũ�Ⱦ�Ϊ0.01mol/L�Ģ�NaCN����CH3COONa����NaCl ��Һ�У���������Ũ���ɴ�С��˳��Ϊ_______(�����)��
(6)NaCN��һ����Ҫ�Ļ�������ԭ�ϣ�ͬʱҲ��һ�־綾���ʣ�����Σ�����ཡ�����������·����ⶨ������ķ�ˮ��NaCN�ĺ�������֪��
�ٷ�ˮ��NaCN ������ŷű�Ϊ0.50mg/L��
��Ag+ +2CN-=[Ag(CN)2]-��Ag++I-=AgI����AgI�����ʻ�ɫ����CN- ������Ag+��Ӧ��
ʵ�����£�20.00mL������ĺ�NaCN �ķ�ˮ����ƿ�У����μӼ���KI ��Һ��ָʾ������1.00��10-4mol/L�ı�AgNO3��Һ�ζ�������AgNO3��Һ�����Ϊ15.00mL��
�ٵζ�ʱ1.00��10-4mol/L�ı�AgNO3��ҺӦ��______(����������)ʢװ���ζ��յ�ʱ��������_________��
�ڴ�����ĺ�NaCN �ķ�ˮ�Ƿ�ﵽ�ŷű�_____(��ǡ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����Һ����������������еĹ�ͬ������
A.�����ڷ�ɢϵB.����������Ĥ
C.���ܲ��������ЧӦD.������ͬ����ɫ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com