
【题目】硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下:
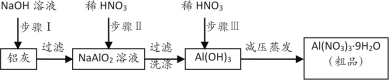
完成下列填空:
(1)常温下,铝遇浓硫酸、浓硝酸时在表面生成致密的氧化膜,这种现象称为__________,铝粉常用来还原一些金属氧化物以冶炼某些难熔的金属,这类氧化还原反应叫__________反应;
(2)步骤Ⅰ的离子方程式是_________________,_________________;
(3)若在实验室中完成步骤Ⅱ,为提高铝元素的利用率,可用__替换稀硝酸;
a.稀硫酸 b.稀盐酸 c.醋酸 d.二氧化碳
(4)在步骤Ⅲ的实际操作过程中,待沉淀完全溶解后还会加入稍过量稀硝酸,用平衡移动原理解释此时加入稀硝酸的目的:_______________________;
(5)温度高于200℃时,硝酸铝完全分解成氧化铝、二氧化氮和氧气,写出该反应的化学方程式:_____________。
【答案】钝化 铝热或置换 2Al+2OH-+2H2O=2AlO2-+3H2↑ Al2O3+2OH-=2AlO2-+H2O cd Al3++3H2O≒Al(OH)3+3H+,加过量HNO3平衡向左移动,抑制Al3+水解 4Al(NO3)3![]() 2Al2O3+12NO2↑+3O2↑
2Al2O3+12NO2↑+3O2↑
【解析】
本题主要考查铝、氧化铝的重要性质及应用。要特别关注铝的钝化、铝热反应、氧化铝和氢氧化铝的两性等知识的应用。
(1)常温下,铝遇浓硫酸、浓硝酸时,在铝表面迅速生成致密的氧化物保护薄膜,这种现象称为钝化现象。钝化不是铝与浓硫酸、浓硝酸不发生反应,而是反应迅速进行,迅速停止;铝粉与某些金属氧化物的混合粉末称为铝热剂,引发后发生反应产生很高的温度,可用以冶炼某些难熔的金属,这类氧化还原反应称为铝热反应,其实质是置换反应;
(2)铝灰中的主要成分Al、Al2O3均能与NaOH溶液反应,Fe2O3与NaOH溶液不反应:2Al+2OH-+2H2O=2AlO2-+3H2↑;Al2O3+2OH-=2AlO2-+H2O;
(3)Al(OH)3既溶于强酸又溶于强碱,既不溶于弱酸又不溶于弱碱,所以若在实验室中完成步骤Ⅱ,为提高铝元素的利用率,可用弱酸替换稀硝酸这一强酸,故可选用醋酸和二氧化碳这两种弱酸,其中二氧化碳更好;
(4)Al(NO3)3中Al3+会水解:Al3++3H2O≒Al(OH)3+3H+,加过量HNO3可向溶液提供H+使平衡向左移动,从而抑制Al3+水解,同时不引入新的杂质离子;
(5)题目已明确告知反应物是硝酸铝,产物有氧化铝、二氧化氮和氧气,配平即可得:4Al(NO3)3![]() 2Al2O3+12NO2↑+3O2↑,注意标明温度高于200℃。
2Al2O3+12NO2↑+3O2↑,注意标明温度高于200℃。


科目:高中化学 来源: 题型:
【题目】资源化利用CO具有重要意义。
(1)CO可设计成燃料电池,熔融Li2CO3和Na2CO3的混合物作为燃料电池的电解质,氧化剂是含CO2的O2,工作时正极反应为__________________,以该燃料电池为电源处理含氮氧化物废气,可回收硝酸,同时制得副产物氢气,装置如图所示(电极均为石墨电极)。该装置中应选用_______(填“阴”或“阳”)离子交换膜,写出电解时NO2发生反应的电极反应式:___________________。

(2)CO是高炉炼铁的重要还原剂,炼铁时发生的主要反应有:
反应 | △H(kJ/mol) |
I. Fe2O3(s)+3C(s) | +489 |
II. Fe2O3(s)+3CO(g) | -27 |
III. C(s)+CO2(g) | X |
试计算,试计算,X=_________。
T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应I,反应达到平衡后,在t1时刻改变某条件,v(逆)随时间(t)的变化关系如图所示,则t1时刻改变的条件可能是_____________________。
a.保持温度、体积不变,使用催化剂 b.保持体积不变,升高温度
c.保持温度不变,压缩容器体积 d.保持温度、体积不变,充入CO

(3)在一定温度下,向某体积可变的恒压(P总)密闭容器中加入1mol CO2与足量的碳发生反应III,平衡时体系中气体体积分数与温度的关系如图所示。
①650℃时,反应达平衡后CO2的转化率为____________。
②T℃时,该反应达到平衡时下列说法不正确的是__________________。
a.气体密度保持不变
b.2v正(CO2)=v正(CO)
c.若保持其它条件不变再充入等体积的CO2和CO,平衡向逆反应方向移动
d.若保持其它条件不变再充入惰性气体,v正、v逆均减小,平衡不移动
e.若其它条件不变将容器体积压缩至一半并维持体积不变,再次达平衡时压强小于原平衡的2倍
③根据图中数据,计算反应III在T℃时用平衡分压代替平衡浓度表示的化学平衡常数KP=___________(设总压强为P总,用含P总的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH值 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g) ![]() H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g) ![]() H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g)
2NO(g) ![]() H>0
H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的![]() H>0,简述该设想能否实现的依据 。
H>0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下,11.2L HF含有的分子数目为0.5NA
B. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
C. 常温下,0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子数小于0.2NA
D. 18g葡萄糖(C6H12O6)分子含有的羟基数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性溶液X中含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、S![]() 、Cl-、N
、Cl-、N![]() 。中的一种或几种,取该溶液进行连续实验,实验过程如下:(已知气体D在常温常压下呈红棕色)
。中的一种或几种,取该溶液进行连续实验,实验过程如下:(已知气体D在常温常压下呈红棕色)

(1)上述离子中,溶液X中除H+外肯定还含有的离子是_,一定不含的离子是__,不能确定是否含有的离子是_______,检验其中阳离子的方法是________。
(2)沉淀G的化学式为______。
(3)写出生成A的离子方程式:________。
(4)写出溶液H中通入过量CO2的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。请补充完成该实验报告。
(1)(实验原理)
溶液的导电性由溶液中离子的浓度及离子电荷数决定。观察_____,据此判断溶液中自由移动的离子浓度的变化,从而证明反应是离子反应。
(2)(实验装置)如图1所示。

(实验过程与记录)
实验步骤 | 实验现象 | 实验结论 |
连接好装置,向烧杯中加入25mL1molL﹣1的Ba(OH)2溶液和2滴酚酞溶液,逐滴滴加1molL﹣1的H2SO4溶液直至过量,边滴边振荡。 | (2)_____(填写支持实验结论的证据) | Ba(OH)2溶液和H2SO4溶液的反应是离子反应 |
(3)整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)可近似地用图2中的_____(填序号)曲线表示。
(4)下列三种情况下,与上述实验中离子方程式相同的是_____。
A 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
B 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至至溶液显中性
C 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(5)已知:PbSO4难溶于水,但可溶于醋酸氨溶液中形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.写出该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向物质X中逐渐加入(或通入)Y溶液,生成沉淀的量与加入Y的物质的量关系如图所示,下表中符合图示情况的是

A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol/L。下列判断错误的是( )
xC(g)+2D(g)。2 min后该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol/L。下列判断错误的是( )
A. x=1 B. 2 min内A的反应速率为0.3 mol·L-1·min-1
C. B的转化率为40% D. 若混合气体的密度不变则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂排放的污水中含有FeSO4、CuSO4两种物质。甲、乙、丙三位学生分别设计了从该污水中回收纯净金属铜的方案(如图所示)。
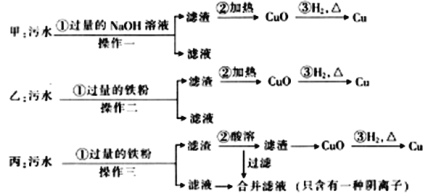
(1)甲、乙、丙提出的实验方案能否得到纯净的金属铜?
甲___,乙___,丙___。(填“能”或“不能”)
(2)在丙同学进行的“酸溶”操作中,加入的酸是___(填“稀盐酸”或“稀硫酸“)。合并的滤液中的主要溶质是___。
(3)丙同学的方案中,过程①加入过量的铁粉时发生反应的化学方程式为___。
(4)操作一、二、三的名称是___,该操作中需使用的玻璃仪器有___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com