
【题目】某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH值 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g) ![]() H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g) ![]() H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g)
2NO(g) ![]() H>0
H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的![]() H>0,简述该设想能否实现的依据 。
H>0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
【答案】
(1)酸性;4;
(2)①C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3KJ/mol;②a、b;
(3)①4×10-6;温度越高,反应速率加快,平衡右移;②该反应是焓增,熵减的反应,任何温度下均不自发进行;③2CO+2NO![]() 2CO2+N2
2CO2+N2
【解析】
(1)考查溶液中的电荷守恒具体计算,c(K+)+ c(H+)+ c(Na+)+c(NH4+)= c(OH—)+ 2 c(SO42—)+2 c(NO3—)+ cCl—),而c(OH—)·c(H+)=10-14,代入具体数据计算可得:c(OH—)=10-10mol/L,c(H+)=10-4 mol/L;
(2)①由盖斯定律,两式相加可得:C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3KJ/mol;②吸收SO2可用ab;
(3)①由题目未告诉容器体积,不妨令为1L注意近似处理,平衡时: c(N2)=0.8mol/L, c(O2) =0.2mol/L, ,c(NO)=8×10-8mol/L,将数据代入K=c2(NO)÷[c(N2)·c(O2)]= 4×10-6;因为该反应为吸热反应,温度越高,反应速率加快,平衡右移;②该反应是焓增,熵减的反应,由ΔG=ΔH-TΔS,任何温度下均不自发进行;③产物为N2和CO2才无污染:2CO+2NO![]() 2CO2+N2
2CO2+N2
【规律提升】(1)溶液中的守恒规律要能够灵活运用,pH计算式不要忽略水的离子积,并看清温度限制;(2)盖斯定律的运功要学会加减法的运用,符号不要弄反;(3)平衡常数有关计算时,近似处理(两个数相加减相差100倍以上,可以忽略小的数)、假设处理(例如假设体积)、三阶段式等比较重要;(4)利用ΔG=ΔH-TΔS判断反应进行方向一定不要把符号弄反。


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有K+、Ca2+、AlO2-、SiO32-、CO32-、SO42-中的若干种离子.某同学对该溶有进行了如下实验下列判断正确的是( )

A.K+、AlO2-、SiO32-和CO32-一定存在于溶液X中
B.沉淀甲是硅酸和硅酸钙的混合物
C.气体甲一定是纯净物
D.SO42-一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铁屑(主要成分为Fe,还含有C,S,P等)制取高效净水剂K2FeO4流程如图:

下列说法不正确的是
A. 废铁屑在酸溶前可用热的纯碱溶液去油污
B. 步骤②是将Fe2+转化为Fe(OH)3
C. 步骤③中发生的反应的离子方程式为2Fe(OH)3+3ClO-==2FeO42-+3Cl-+4H++H2O
D. 步骤④中反应能发生的原因是在相同条件下,K2FeO4的溶解度小于Na2FeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度恒定的条件下,在2 L容积不变的密闭容器中,发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。开始充入4 mol的SO2和2 mol的O2,10 s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是 ( )
2SO3(g)。开始充入4 mol的SO2和2 mol的O2,10 s后达到平衡状态,此时c(SO3)=0.5 mol·L-1,下列说法不正确的是 ( )
A.v(SO2)∶v(O2)=2∶1B.10 s内,v(SO3)=0.05 mol·L-1·s-1
C.SO2的平衡转化率为25%D.平衡时容器内的压强是反应前的5/6倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下: 电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3O2![]() Al2O3+3H2↑电解过程中,以下判断正确的是( )
Al2O3+3H2↑电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
D |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。则A的相对分子质量为:______。
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为:________。
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。用结构简式表示A中含有的官能团:______________________。
(4)A的核磁共振氢谱如下图:则A中含有__________种氢原子。
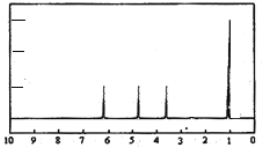
(5)综上所述,A的结构简式_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)将浓度均为0.1 mol·L-1的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=_____mol·L-1。
(2)医学上进行消化系统的X射线透视时,常使用BaSO4作内服造影剂。胃酸酸性很强( pH约为1), 但服用大量BaSO4仍然是安全的,BaSO4不溶于酸的原因是_______________________。(用沉淀溶解平衡原理解释)。万一误服了少量BaCO3,应尽快用大量0.5mol·L-1Na2SO4溶液给患者洗胃,如果忽略洗胃过程中Na2SO4溶液浓度的变化,残留在胃液中的Ba2+浓度仅为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铝[Al(NO3)3]是一种常用媒染剂。工业上用铝灰(主要含Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3·9H2O]的流程如下:
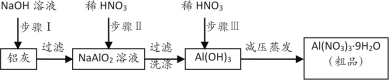
完成下列填空:
(1)常温下,铝遇浓硫酸、浓硝酸时在表面生成致密的氧化膜,这种现象称为__________,铝粉常用来还原一些金属氧化物以冶炼某些难熔的金属,这类氧化还原反应叫__________反应;
(2)步骤Ⅰ的离子方程式是_________________,_________________;
(3)若在实验室中完成步骤Ⅱ,为提高铝元素的利用率,可用__替换稀硝酸;
a.稀硫酸 b.稀盐酸 c.醋酸 d.二氧化碳
(4)在步骤Ⅲ的实际操作过程中,待沉淀完全溶解后还会加入稍过量稀硝酸,用平衡移动原理解释此时加入稀硝酸的目的:_______________________;
(5)温度高于200℃时,硝酸铝完全分解成氧化铝、二氧化氮和氧气,写出该反应的化学方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中粒子的物质的量浓度关系正确的是( )
A. 0.1 mol/L NaHCO3溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(OH-)
)>c(OH-)
B. 20 mL 0.1 mol/L CH3COONa溶液与10 mL 0.1 mol/L HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C. 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)+c(H+)>c(NH![]() )+c(OH-)
)+c(OH-)
D. 0.1 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合,所得溶液中: c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com