
【题目】雾霾天气严重影响人们的生活和健康。其中首要污染物为可吸入颗粒物PM2.5,其主要来源为燃煤、机动车尾气等。因此改善能源结构、机动车限号等措施能有效减少PM2.5。SO2、NOx等污染。
请回答下列问题:
(1)将一定量的某PM2.5 样品用蒸馏水溶解制成待测试样(忽略OH-)。常温下测得该试样的组成及其浓度如下表:根据表中数据判断该试样的pH=________。
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | CI- |
浓度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
(2)已知汽车汽缸中NO的生成反应为:N2(g)+ O2(g) ![]() 2NO(g) △H>0恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是______________。
2NO(g) △H>0恒温,恒容密闭容器中,下列说法中,能说明该反应达到化学平衡状态的是______________。
A.混合气体的密度不再变化 B.混合气体的压强不再变化
C.氧气的转化率不再变化 D.N2、O2、NO的物质的量之比为1: 1: 2
(3)为减少SO2 的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) △H= -241.8kJ/mol
C(s)+1/2O2(g)==CO(g) △H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式:__________________________。
②洗涤含SO2的烟气。下列可作为洗涤含SO2烟气的洗涤剂是________。
A.浓氨水 B.碳酸氢钠饱和溶液
C.FeCl2饱和溶液 D.酸性CaCl2饱和溶液
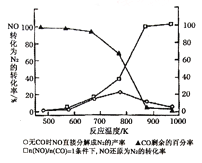
(4)汽车使用乙醇汽油并不能减少NOx的排放,这使NOx的有效消除成为环保领域的重要课题。某研究性小组在实验室以Ag-ZSM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图所示。若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为____________,在n(NO)/n(CO)=1的条件下,为更好的除去NOx物质,应控制的最佳温度在______K左右。
(5)车辆排放的氮氧化物、煤燃烧产生的二氧化硫是导致雾霾天气的“罪魁祸首”。活性炭可处理大气污染物NO。在5L密闭容器中加入NO 和活性炭(假设无杂质),一定条件下生成气体E和F。当温度分别在T1℃和T2℃时,测得各物质平衡时物质的量(n/mol)如下表:

①写出NO与活性炭反应的化学方程式____________________________。
②若T12,则该反应的△H_____________0(填”>”、“<”或“=”)。
③上述反应T1℃时达到化学平衡后再通入0.lmol NO气体,则达到新化学平衡时NO的转化率为___________________。
【答案】 4 C C(s)+H2O(g)==CO(g)+H2(g) △H=+131.3 kJ/mol AB NO 的分解反应是放热反应,升高温度不利于反应进行 870 C(s)+2NO(g)![]() CO2(g)+N2(g) < 80 %
CO2(g)+N2(g) < 80 %
【解析】(1)溶将PM2.5样本用蒸馏水处理制成待测试样.则该试样中除了水溶性无机离子外,还一定含H+和OH-。根据溶液中电荷守恒可知:c(K+)+c(NH4+)+c(Na+)+c(H+) =2c(SO42-)+c(NO3-)+c(Cl-)+c(OH-)①,而溶液应满足水的离子积KW=c(H+)c(OH-)=10-14②,联立①②可解得c(H+)=1×10-4molL-1,则pH值为4,故答案为:4;
(2)N2(g)+O2(g)2NO(g)△H>0恒温,恒容密闭容器中,A.反应前后气体质量不变,体积不变,混合气体的密度始终不变化,不能说明反应达到平衡状态,故A错误;B.反应前后气体质量不变,气体物质的量不变,混合气体的压强始终不变化,所以不能说明反应达到平衡状态,故B错误;C.氧气的转化率不再变化,说明正逆反应速率相等,反应达平衡状态,故C正确;D.N2、O2、NO的物质的量之比为1:1:2 不能说明正逆反应速率相同,故D错误;故答案为:C;
(3)①已知:①H2(g)+![]() O2(g)═H2O(g) △H=-241.8kJmol-1,②C(s)+
O2(g)═H2O(g) △H=-241.8kJmol-1,②C(s)+![]() O2(g)═CO(g) △H=-110.5kJmol-1,利用盖斯定律,将②-①可得:C(s)+H2O(g)=CO(g)+H2(g),△H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,所以焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g) △H=+13l.3kJmol-1,故答案为:C(s)+H2O(g)═CO(g)+H2(g) △H=+13l.3kJmol-1;
O2(g)═CO(g) △H=-110.5kJmol-1,利用盖斯定律,将②-①可得:C(s)+H2O(g)=CO(g)+H2(g),△H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,所以焦炭与水蒸气反应的热化学方程式为:C(s)+H2O(g)═CO(g)+H2(g) △H=+13l.3kJmol-1,故答案为:C(s)+H2O(g)═CO(g)+H2(g) △H=+13l.3kJmol-1;
②A.二氧化硫是酸性氧化物所以具有酸性氧化物的通性能够与浓氨水反应,可以用浓氨水吸收二氧化硫,故A正确;B.二氧化硫水溶液是亚硫酸所以也能够与碳酸氢钠饱和溶液反应,生成二氧化碳气体,可以用碳酸氢钠溶液做洗涤剂,故B正确;C.二氧化硫对应的酸是亚硫酸,酸性比盐酸酸性弱,所以二氧化硫与氯化亚铁不反应,故C错误;D.二氧化硫与氯化钙溶液不反应,不能用氯化钙溶液吸收二氧化硫,故D错误;故选:AB;
(4)升高温度,发现NO的分解率降低,说明反应向逆反应方向进行,该反应放热;由图可知,在![]() =1的条件下,870K时,NO还原为N2的转化率接近为100%;故答案为:NO的分解反应是放热反应,升温有利于反应逆向进行;870;
=1的条件下,870K时,NO还原为N2的转化率接近为100%;故答案为:NO的分解反应是放热反应,升温有利于反应逆向进行;870;
(5)由表中数据可知,C、NO、E、F的化学计量数之比为(3.000-2.960):(0.10-0.020):0.040:0.040=1:2:1:1,反应中C被氧化。
①结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,反应方程式为C+2NON2+CO2,故答案为:C+2NON2+CO2;
②T1<T2,图表中NO随温度升高增大,说明升温平衡逆向进行,正反应为放热反应,该反应△H<0,故答案为:<;
③反应C+2NON2+CO2是一个气体体积不变的反应,而反应物只有一种,故加入NO气体,建立的平衡和原平衡为等效平衡,原平衡中NO转化率为 ![]() ×100%=80%,则达到新平衡时NO的转化率为80%,故答案为:80%。
×100%=80%,则达到新平衡时NO的转化率为80%,故答案为:80%。


科目:高中化学 来源: 题型:
【题目】实验室需要配置100 mL 1.0×10-2 mol·L-1的CuSO4溶液,下列玻璃仪器中,一定要用到的有( )
A. 漏斗 B. 玻璃棒 C. 烧杯 D. 容量瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学是你,化学是我”.化学与生产、生活密切相关,下列说法错误的是( )
A. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B. 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质
C. 开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济”
D. 二氧化硫有漂白性,常用于棉、麻、纸张和食品的漂白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下列各图所示是中学化学中常用于混合物分离和提纯的装置:
A. 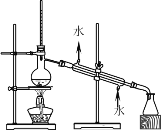 B.
B. 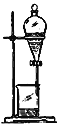
C.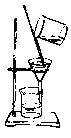 D.
D. 
请根据装置图回答下列问题:
⑴A图中用于盛放液体混合物的仪器的名称为:__________________
⑵选择合适的实验装置分离以下混合物(填代表装置的字母),
①从碘水中分离出I2 : ___________
②进行酒精和水的分离: ___________
③二氧化锰和蔗糖溶液: ___________
⑶我国具有历史悠久的酒文化,请回答下列问题:
①要提高酒精的度数,可采用的方法是________________(填操作方法,下同)
②中药常常浸泡在美酒中制成药酒,你认为利用的方法是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。一旦泄露需要及时处理,一般可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻环境污染。 I.已知:氧化钠化学式为NaCN,氰化钠是一种白色结晶颗粒,剧毒,易溶于水,水溶液呈碱性,易水解生成氰化氢。
(1)请设计实验证明N、C 元素的非金属性强弱:____________________。
(2)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润红色石蕊试纸变蓝的气体,该反应的离子方程式是_______________________________。
II.工业制备硫代硫酸钠的反应原理为2Na2S+Na2CO3+4SO2==3Na2S2O3+CO2。某化学兴趣小组用上述原理实验室制备硫代硫酸钠,并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
【实验一】实验室通过如下图所示装置制备Na2S2O3。
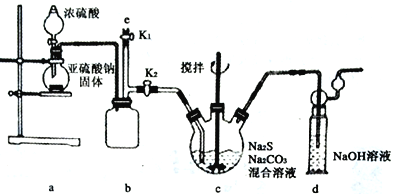
(1)实验中要控制SO2 生成速率,可采取的措施有_______________________(写出一条)。
(2)b装置的作用是____________________________________。
(3)反应开始后,c中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为___________(填化学式)。
(4)实验结束后,在e处最好连接盛_________(填“NaOH 溶液”、“水”、“CCl4” 中一种)的注射器,接下来的操作为关闭K2 打开K1,最后拆除装置。
【实验二】测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L;
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
实验如下:取200.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,
用1.00×10-4mol/L 的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
(5)滴定终点的现象:________________________________________。
(6)处理后的废水是否达到排放标准:_______________________________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。下列说法正确的是
A. 标准状况下,22.4L氨气溶于足量水后含有NA个分子
B. lmol/L的NaClO溶液中含有CIO-的数目小于NA
C. 60gSiO2中含有4molSi-O键
D. lmolN2和4molH2充分反应生成NH3时转移电子总数是6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜元素位于元素周期表中第ⅠB族,在化合物中其化合价可以呈现+1、+2价。铜的单质及其化合物在很多领域有重要的应用。
Ⅰ.CuSO4和Cu(NO3)2是常见的+2价铜的化合物,有较为广泛的应用。
(1)向CuSO4溶液中滴加氨水,最后可以得到深蓝色的[Cu(NH3)4]SO4溶液。
N、O、S三种元素的第一电离能由大到小的顺序为______________________________。
(2)制备Cu(NO3)2的一种方法是在N2O4的乙酸乙酯溶液中加入铜,反应一段时间后,加热即可得到Cu(NO3)2。NO3-的立体构型的名称为_______________,N原子的杂化方式为________________。NO3-的一种等电子体为________________________。
Ⅱ.CuCl是较为常见的十1价铜的化合物。
(3)基态Cu+的价层电子排布式为________________________。
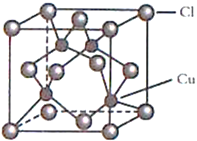
(4)CuCl的晶胞结构如图所示,C1原子位于立方体的顶点和面心, Cu原子位于Cl原子构成的四面体体心。每个Cl原子周围距Cl原子最近且等距离的Cu原子数目为________________。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安全是顺利进行实验及避免伤害的保障.下列实验操作正确且不是从实验安全角度考虑的是( )

A. 操作①:使用稍浸入液面下的倒扣漏斗检验氢气的纯度
B. 操作②:使用CCl4萃取溴水中的溴时,振荡后需打开活塞使漏斗内气体放出
C. 操作③:吸收氨气或氯化氢气体并防止倒吸
D. 操作④:用食指顶住瓶塞,另一只手托住瓶底,把瓶倒立,检查容量瓶是否漏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com