
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.0.1molCl2常温下与过量NaOH溶液反应转移电子总数为 0.1NA
B.25℃时, pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
C.0.25mol Na2O2中含有的阴离子数为0.5 NA
D.1L0.1mol·L-1的硫化钠溶液中硫离子数目为0.1NA
科目:高中化学 来源:2015届河南省偃师市高三上学期第一次月考化学试卷(解析版) 题型:选择题
有Al、CuO、Fe2O3组成的混合物共10.0 g,放入500 mL某浓度的盐酸溶液中,混合物完全溶解,当再加入250 mL 2.0 mol/L的NaOH溶液时,得到的沉淀最多。上述盐酸溶液的浓度为
A.0.5 mol /L B.1.0 mol/L C.2.0 mol/LD.3.0 mol/L
查看答案和解析>>
科目:高中化学 来源:2015届河北省邯郸市高三第一次调研考试化学试卷(解析版) 题型:选择题
下列关于钠的化合物的说法中,正确的是( )
A.Na2CO3和NaHCO3均能与盐酸和NaOH溶液反应
B.Na2CO3固体中含有的NaHCO3可用加热的方法除去
C.Na2O2和Na2O均为白色固体,与CO2反应均放出O2
D.分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:实验题
(15分)固体硝酸盐加热易分解且产物较复杂。以Mg(NO3)2为研究对象,四个学习小组拟通过实验探究其热分解的产物,分别提出如下4种猜想:
甲组:Mg(NO2)2、NO2、O2 乙组:MgO、NO2、O2
丙组:MgO、NO2、N2 丁组:Mg3N2、O2
(1)实验前,小组成员经讨论认定 组的猜想一定不成立,理由是_____________。
查阅资料得知:2NO2+2NaOH=NaNO3+NaNO2+H2O
针对其他小组猜想,设计如下图所示的实验装置(图中加热、夹持仪器等均省略)进行探究:

A B C D
(2)实验过程
①简述检验该装置气密性的方法 。
②称取硬质试管A的质量为18.0g,试管A与Mg(NO3)2固体共21.8 g置于A中,加热前通入N2以驱尽装置内的空气,其目的是 ;关闭K,用酒精灯加热时,正确操作是先 然后固定在管中固体部位下加热。
③观察到A中有红棕色气体生成,C中有气泡。
④待样品完全分解,A装置冷却至室温、称量,测得硬质试管A和剩余固体的总质量为19.0g。
⑤取少量剩余固体于试管中,加入适量水,未见明显现象。
(3)实验结果分析讨论
①证明一定有O2生成的依据是 ,与此相关的化学原理为(用化学方程式表示) 。
根据实验现象和剩余固体的质量经分析可初步确认猜想_______组结论是正确的。
②一位同学认为上述装置不能确认分解产物中有O2,他的理由你认为可能是 , 如果需改进装置,应该 。
(4)据以上分析,Mg(NO3)2分解的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:选择题
下列实验“操作和现象”与“结论”对应关系正确的是
| 操作和现象 | 结论 |
A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
C | 向饱和Na2CO3溶液中通入足量CO2 ,溶液变浑浊 | 析出了NaHCO3 |
D | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
查看答案和解析>>
科目:高中化学 来源:2015届河北省“五个一名校联盟”高三教学质量监测(一)化学试卷(解析版) 题型:选择题
向溶液X中持续通入过量气体Y,会产生“先浑浊,后澄清”现象的是
A.X:氯化钙溶液 Y:二氧化碳
B.X:硝酸钡溶液 Y:二氧化硫
C.X:氯化铝溶液 Y:氨气
D.X:偏铝酸钠溶液 Y:二氧化氮
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:填空题
(14分)人工固氮是指将氮元素由游离态转化为化合态的过程。
I.最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实验氮的固定一电解法合成氨,大大提高了氮气和氢气的转化率。
总反应式为:N2+3H2  2NH3
2NH3
则在电解法合成氨的过程中,应将H2不断地通入_________极(填“阴”或“阳”) ;
向另一电极通入N2,该电极的反应式为__________________________。
II.据报道,在一定条件下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,主要产物为NH3相应的反应方程式为:2N2(g)+6 H2O (g)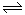 4NH3(g)+3O2(g) △H=Q ①
4NH3(g)+3O2(g) △H=Q ①
(1)上述反应的平衡常数表达式为_______________。
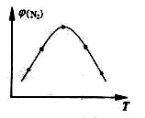
(2)取五份等体积N2和H2O的混合气体(物质的量之比均为1:3), 分别加 入体积相同的恒容密闭容器中,在温度不相同的情况下发生反应,反应相同时间后,测得氮气的体积分数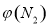 与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
与反应温度T的关系曲线如下图所示,则上述反应的Q________0(填“>”、“<”或“=”)。
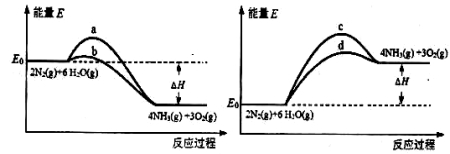
(3)若上述反应在有催化剂的情况下发生,则下图所示的a、b、c、d四条曲线中,能表示反应体系能量变化的是_______(填字母代号),图中△H绝对值为1530kJ·mol-1。
III.目前工业合成氨的原理是: N2(g)+3H2(g)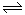 2NH3(g) △H=-93.0kJ/mol ②
2NH3(g) △H=-93.0kJ/mol ②
回答下列问题:
(1)结合II中的数据,则2H2(g)+ O2(g)=2 H2O (g)的△H=___________。
(2)在一定温度下,将1molN2和3mol H2混合置于体积不变的密闭容器中发生反应,达到平衡状态时,测得气体总物质的量为2.8mol。
①达平衡时,H2的转化率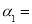 ______________。
______________。
②在相同条件下,若起始时只将NH3置于该容器中,达到平衡状态时NH3的转化率
为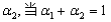 时,则起始时NH3的物质的量
时,则起始时NH3的物质的量 _________mol。
_________mol。
查看答案和解析>>
科目:高中化学 来源:2015届河北正定中学上学期高三第一次考试化学试卷(解析版) 题型:选择题
下列说法中错误的是 ( )
A.从1 L 1 mol/L的NaCl溶液中取出10 mL,其浓度仍是1 mol/L
B.制成0.5 L 10 mol/L的盐酸,需要氯化氢气体112 L(标准状况)
C.0.5 L 2 mol/L BaCl2溶液中,Ba2+和Cl-总数为3×6.02×1023
D.10 g 98%的硫酸(密度为1.84 g/cm3)与10 mL 18.4 mol/L硫酸的浓度是不同的
查看答案和解析>>
科目:高中化学 来源:2015届江西省高三上学期第一次月考化学试卷(解析版) 题型:选择题
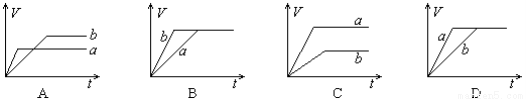
等质量的两份锌粉a和b,分别加入过量的稀硫酸中,a中同时加入少量CuSO4,下列图中表示其产生H2总体积(V)与时间(t)的关系正确的是( )
 、
、
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com