
| A. | 改变某平衡体系的温度 | |
| B. | 有气态物质参加的可逆反应达到平衡后,改变压强 | |
| C. | 使平衡混合物中各组分的浓度发生变化 | |
| D. | 可逆反应达到平衡后,使用催化剂 |
分析 可根据化学平衡移动的因素以及可以反应的类型来综合分析,一定条件下,当改变其中一个条件,平衡向减弱这种改变的方向进行;
A、改变温度,平衡一定发生移动;
B、反应前后气体 物质的量不变的反应,平衡移动,压强不变;
C、当平衡混合物各组分的浓度发生同等程度的变化时,化学平衡未必发生移动,各组分的浓度发生不同程度的变化时,就说明化学平衡向某个方向;
D、催化剂改变反应速率不改变化学平衡;
解答 解:A.改变温度,平衡一定发生移动,故A正确;
B.对于气体总体积反应前后不变的可逆反应来说,无论是否建立平衡,其总物质的量即压强都不会发生变化;对于气体总体积反应前后不等的可逆反应来说,建立化学平衡状态时,总物质的量要与初始时的总物质的量不等,故压强要改变,故B错误;
C.当平衡混合物各组分的浓度发生不同程度的变化时,就说明化学平衡向某个方向(正反应方向或逆反应方向)进行,即化学平衡发生了移动,当平衡混合物各组分的浓度发生同等程度的变化时,化学平衡未必发生移动,如对于I2+H2=2HI来说,当增大加强减小体积时,就不会发生化学平衡的移动,故C错误;
D.催化剂只能同等程度地改变正反应速率和逆反应速率,当一个可逆反应建立化学平衡状态后,加入催化剂,正反应速率仍然等于逆反应速率,化学平衡不会发生移动,故D错误;
故选A.
点评 本题要求要能灵活运用影响化学平衡的因素来分思考问题,是对基础知识灵活运用的考查,要求学习时一定要记住并能深刻理解,题目较简单..


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2 | B. | CO | C. | CH4 | D. | 煤气(CO和H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
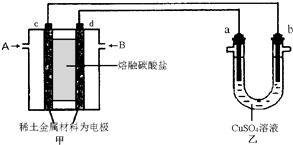
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酯类物质是形成水果香味的主要成分 | |
| B. | 油脂的皂化反应生成脂肪酸和丙醇 | |
| C. | 蛋白质的水解产物都含有醛基和氨基 | |
| D. | 糖类化合物都具有相同的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
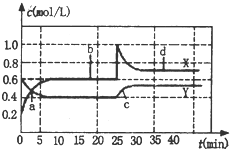 已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )
已知NO2和N2O4可以相互转化:2NO2 (g)?N2O4 (g)△H<0,现将一定量NO2和N2O4的混合气体,通入体积为1L的恒温密闭容器中,反应物浓度随时间变化关系如图.下列说法错误的是( )| A. | 图中共有两条曲线X和Y,其中曲线X表示 NO2浓度随时间的变化 | |
| B. | a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d | |
| C. | 若要达到与d相同的状态,在25min时还能采取的措施是适当缩小容器体积 | |
| D. | 反应进行至25min时,曲线发生变化的原因是加入0.4 mol N2O4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
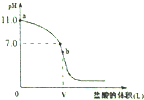 常温时,向浓度为0.1mol/L体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而变化的滴定曲线如图所示,b点表示两种溶液恰好完全反应.
常温时,向浓度为0.1mol/L体积为V L的氨水中逐滴加入一定浓度的盐酸,用pH计测得溶液的pH随盐酸的加入量而变化的滴定曲线如图所示,b点表示两种溶液恰好完全反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
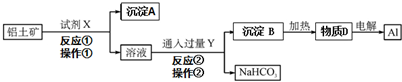
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
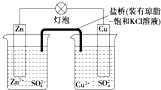
| A. | 正极反应为:Zn-2e-═Zn2+ | B. | 盐桥中的K+移向ZnSO4溶液 | ||
| C. | 在外电路中,电流从负极流向正极 | D. | 电池反应为:Zn+Cu2+═Zn2++Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com