
【题目】二氟磷酸锂(LiPO2F2)作为电解液添加剂能够有效提升锂电池的循环性能。在氮气气氛下,在PFA(全氟烷氧基树脂)烧瓶中加入高纯LiPF6和Li2CO3固体,以碳酸二甲酯作溶剂制备LiPO2F2,其流程如下:
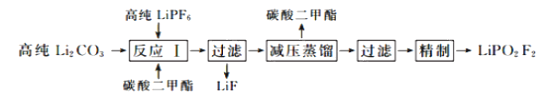
已知:LiPF6是一种白色结晶或粉末,潮解性强,遇水发生反应如下:LiPF6+H2O![]() LiF+POF3↑+2HF↑
LiF+POF3↑+2HF↑
(1)反应Ⅰ需要控制在60℃的条件下进行,适宜的加热方式为_____________。
(2)反应Ⅰ中有一种无色无味的气体生成,该气体的电子式为_______________。反应Ⅰ的化学方程式为______________________________________。
(3)高纯LiPF6需要控制适当过量的原因可能是_____________________________。 LiPO2F2制备过程中不采用玻璃仪器的原因是____________________________。
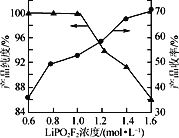
(4)保持其他实验条件都不变,在精制过程中加入提纯溶剂(杂质和LiPO2F2均可溶解在提纯溶剂中),LiPO2F2在提纯溶剂中的浓度对产品纯度和收率(收率=![]() ×100%)的影响如图所示。由图可知,随着LiPO2F2浓度的减小,产品纯度逐渐增大,收率逐渐降低。其原因可能是_______
×100%)的影响如图所示。由图可知,随着LiPO2F2浓度的减小,产品纯度逐渐增大,收率逐渐降低。其原因可能是_______
(5)已知:常温下,碳酸锂微溶于水,碳酸氢锂可溶于水。工业级碳酸锂中含有少量难溶于水且与CO2不反应的杂质。请设计从工业级碳酸锂制备高纯碳酸锂的实验方案。(实验中须使用的试剂有:去离子水,CO2气体;除常用仪器外须使用的仪器:恒温水浴锅、真空干燥箱)__________
(6)已知碳酸锂Ksp=8.6×10-4,向浓度为0.2mol·L-1的硫酸锂溶液中加入等体积的碳酸钠溶液产生沉淀,则所加碳酸钠溶液的最低浓度为______________________。
【答案】:水浴加热 ![]() LiPF6+2Li2CO3
LiPF6+2Li2CO3![]() LiPO2F2+2CO2↑+LiF LiPF6易潮解,遇水反应会损耗 玻璃中含有SiO2会与含氟物质发生反应 当加入越多的提纯溶剂,会溶解更多的杂质,产品的纯度提高,但同时也溶解了越来越多的LiPO2F2产品,导致产品收率降低 向工业级碳酸锂中加入一定量的去离子水,搅拌均匀,通入过量CO2气体,过滤,将滤液置于恒温水浴锅中至大量固体析出,过滤,用去离子水洗涤,真空干燥箱干燥,得到高纯度碳酸锂 0.043mol/L
LiPO2F2+2CO2↑+LiF LiPF6易潮解,遇水反应会损耗 玻璃中含有SiO2会与含氟物质发生反应 当加入越多的提纯溶剂,会溶解更多的杂质,产品的纯度提高,但同时也溶解了越来越多的LiPO2F2产品,导致产品收率降低 向工业级碳酸锂中加入一定量的去离子水,搅拌均匀,通入过量CO2气体,过滤,将滤液置于恒温水浴锅中至大量固体析出,过滤,用去离子水洗涤,真空干燥箱干燥,得到高纯度碳酸锂 0.043mol/L
【解析】
根据流程图中反应物和生成物的性质及原子守恒原理判断生成物,书写反应方程式;根据二氧化碳的成键特点书写电子式;根据题干信息中物质的性质分析分离与提纯过程中的操作方法;根据溶度积表达式计算沉淀时溶液中的离子浓度。
(1)要控制在60℃的条件下进行,则适宜的加热方式为水浴加热,故答案为:水浴加热;
(2)反应I中有Li2CO3参加,则生成的无色无味气体为二氧化碳,属于共价化合物,电子式为![]() ;根据流程图知反应I中的反应物为LiPF6和Li2CO3,产物为LiPO2F2、CO2和LiF,则反应方程式为:LiPF6+2Li2CO3
;根据流程图知反应I中的反应物为LiPF6和Li2CO3,产物为LiPO2F2、CO2和LiF,则反应方程式为:LiPF6+2Li2CO3![]() LiPO2F2+2CO2↑+LiF;
LiPO2F2+2CO2↑+LiF;
故答案为:![]() ;LiPF6+2Li2CO3
;LiPF6+2Li2CO3![]() LiPO2F2+2CO2↑+LiF;
LiPO2F2+2CO2↑+LiF;
(3)根据题干信息知,LiPF6易潮解,遇水反应会损耗,需要控制适当过量;玻璃中含有SiO2会与含氟物质发生反应,所以不采用玻璃仪器,故答案为:LiPF6易潮解,遇水反应会损耗;玻璃中含有SiO2会与含氟物质发生反应;
(4)根据收率表达式(收率=![]() ×100%)及题干信息分析知,当加入越多的提纯溶剂,会溶解更多的杂质,产品的纯度提高,但同时也溶解了越来越多的LiPO2F2产品,导致产品收率降低,故答案为:当加入越多的提纯溶剂,会溶解更多的杂质,产品的纯度提高,但同时也溶解了越来越多的LiPO2F2产品,导致产品收率降低;
×100%)及题干信息分析知,当加入越多的提纯溶剂,会溶解更多的杂质,产品的纯度提高,但同时也溶解了越来越多的LiPO2F2产品,导致产品收率降低,故答案为:当加入越多的提纯溶剂,会溶解更多的杂质,产品的纯度提高,但同时也溶解了越来越多的LiPO2F2产品,导致产品收率降低;
(5)根据题干信息知,通入二氧化碳气体可以将微溶碳酸锂转化为可溶的碳酸氢锂,过滤方法除去难溶杂质,然后加热析出晶体,故答案为:向工业级碳酸锂中加入一定量的去离子水,搅拌均匀,通入过量CO2气体,过滤,将滤液置于恒温水浴锅中至大量固体析出,过滤,用去离子水洗涤,真空干燥箱干燥,得到高纯度碳酸锂;
(6)加入等体积的碳酸钠溶液,则溶液浓度变为原来1/2,Ksp=![]() =8.6×10-4,则c(Na2CO3)=c(CO32-)=
=8.6×10-4,则c(Na2CO3)=c(CO32-)=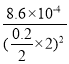 =0.0215mol/L,则所加碳酸钠溶液的最低浓度为0.0215mol/L×2=0.043mol/L,故答案为:0.043mol/L。
=0.0215mol/L,则所加碳酸钠溶液的最低浓度为0.0215mol/L×2=0.043mol/L,故答案为:0.043mol/L。


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】(1)已知Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验一如下(所取溶液体积均为10 mL):
实验编号 | 实验温度/℃ | c(Na2S2O3)/ (mol·L-1) | c(H2SO4)/ (mol·L-1) |
① | 25 | 0.1 | 0.1 |
② | 25 | 0.2 | 0.1 |
③ | 25 | 0.1 | 0.2 |
④ | 50 | 0.2 | 0.1 |
⑤ | 50 | 0.1 | 0.1 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验____________(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时间,可探究______________对化学反应速率的影响。
(2)在一定温度下,若将4a mol H2和2a mol N2放入V L的密闭容器中,5 min后测得N2的转化率为50%,则该段时间用H2表示的反应速率为______________________
实验二:已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较小,溶液褪色不明显;但不久突然褪色,反应速率明显增大。
(3)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率增大。从影响化学反应速率的因素看,你猜想还可能是______________________的影响。
(4)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入______________(填字母序号)。
A.硫酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国前科学院院长卢嘉锡与法裔加拿大科学家 Gignere巧妙地利用尿素(H2NCONH2)和H2O2 形成加合物H2NCONH2 H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供做衍射实验的单晶体,经测定H2O2的结构如下图所示,结合以上信息,下列说法中正确的是 ( )
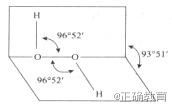
A.H2O2仅有氧化性
B.H2O2是非极性分子,其结构简式为HO—OH
C.H2NCONH2和H2O2是通过氢键结合的
D.任何分子式中的" "都表示氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.将0.1mol氯化铁溶于1L水中,所得溶液含有0.1NA个Fe3+
B.2L0.5mol/L Na2SO4溶液中的Na+数目为2NA
C.1.00 mol NaCl中含有NA个NaCl分子
D.25℃时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向某密闭容器中充入一定量的H2和I2蒸气,发生如下反应:H2(g)+I2(g)![]() 2HI(g),反应达到平衡,下列说法正确的是
2HI(g),反应达到平衡,下列说法正确的是
A.平衡时,正逆反应速率相等且等于零
B.平衡时,c( H2)=c(I2)=c(HI)
C.平衡时只有H2和I2反应生成HI
D.平衡时,混合气体的所有成分的质量分数均保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,对于pH=11的氨水,下列判断正确的是
A. 该氨水的浓度为1.0×10-3mol·L-1
B. 加水稀释,溶液中所有离子的浓度均减小
C. 加水稀释,溶液中c(NH4+)/c(NH3·H2O)变大
D. 与pH=3的盐酸等体积混合,反应后溶液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中 A、B、C、D 、E均为有机化合物。已知:A的分子式为C14H18O4,C能跟 NaHCO3发生反应,C和D的化学式中碳原子数相差1,且相对分子质量相等,E为无支链的链状化合物。
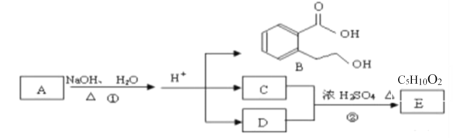
根据上图回答问题:
(1)化合物B中含有的官能团是__________(写名称)
(2)A的结构简式是_______________
(3)①的反应类型是________________.
(4)写出②的化学反应方程式________________
(5)同时符合下列三个条件的B的同分异构体的结构简式_____种,写出核磁共振氢谱有六组峰,峰面积之比为1:2:2:2:2:1的结构简式__________。
Ⅰ.与 FeCl3溶液发生显色反应
Ⅱ.含有对二取代苯环结构
Ⅲ.在酸性或者碱性条件下可以水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:( )
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:( )
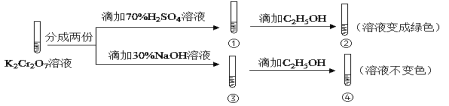
结合实验,下列说法不正确的是( )
A.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
B.①中溶液橙色加深,③中溶液变黄
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.②中Cr2O72-被C2H5OH还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述的化学反应状态,不一定是平衡状态的是( )
A.3H2(g)+N2(g)![]() 2NH3(g)反应体系中H2与N2的物质的量之比保持3∶1
2NH3(g)反应体系中H2与N2的物质的量之比保持3∶1
B.2NO2(g) ![]() N2O4(g)恒温、恒容下,反应体系中气体的压强保持不变
N2O4(g)恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s) ![]() O2(g)+CaO(s)恒温、恒容下,反应体系中气体的密度保持不变
O2(g)+CaO(s)恒温、恒容下,反应体系中气体的密度保持不变
D.H2(g)+Br2(g) ![]() 2HBr(g)恒温、恒容下,反应体系中气体的颜色保持不变
2HBr(g)恒温、恒容下,反应体系中气体的颜色保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com