
【题目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:( )
2CrO42-(黄色)+2H+。用K2Cr2O7溶液进行下列实验:( )
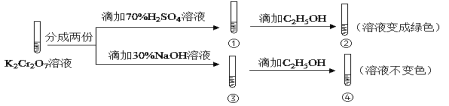
结合实验,下列说法不正确的是( )
A.若向④中加入70%H2SO4溶液至过量,溶液变为橙色
B.①中溶液橙色加深,③中溶液变黄
C.对比②和④可知K2Cr2O7酸性溶液氧化性强
D.②中Cr2O72-被C2H5OH还原
【答案】A
【解析】
K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黄色)+2H+,加入酸,氢离子浓度增大,平衡逆向移动,则溶液橙色加深,加入碱,平衡正向移动,溶液变黄,由实验②、④可知Cr2O72-具有较强的氧化性,可氧化乙醇,而CrO42-不能,以此解答该题。
A.若向④溶液中加入70%的硫酸到过量,溶液为酸性,可以氧化乙醇,溶液变绿色,故A错误。
B.在平衡体系中加入酸,平衡逆向移动,重铬酸根离子浓度增大,橙色加深,加入碱,平衡正向移动,溶液变黄,故B正确
C.②是酸性条件,④是碱性条件,酸性条件下氧化乙醇,而碱性条件不能,说明酸性条件下氧化性强,故C正确;
D.②中重铬酸钾氧化乙醇,重铬酸钾被还原,故D正确;
故答案为A。


科目:高中化学 来源: 题型:
【题目】(1)F2通入稀NaOH溶液中可生成OF2,OF2立体构型为___,其中氧原子的杂化方式为___。
(2)X、Y、Z、R为前四周期元素且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。XY2-的立体构型是___;X与Z形成化合物中含有的化学键是___、R2+的水合离子中,提供孤电子对的原子是___。
(3)ClO3-的立体构型为___(用文字描述,下同);CO32-的立体构型是__。
(4)在BF3分子中:F—B—F的键角是___,B原子的杂化轨道类型为__,BF3和过量NaF作用可生成NaBF4,BF4-的立体构型为___。
(5)用价层电子对互斥理论推断,SnBr2分子中Sn—Br键的键角___(填“>”“<”或“=”)120°。其原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氟磷酸锂(LiPO2F2)作为电解液添加剂能够有效提升锂电池的循环性能。在氮气气氛下,在PFA(全氟烷氧基树脂)烧瓶中加入高纯LiPF6和Li2CO3固体,以碳酸二甲酯作溶剂制备LiPO2F2,其流程如下:
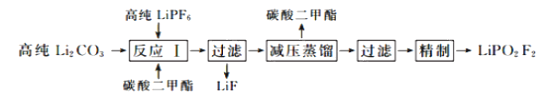
已知:LiPF6是一种白色结晶或粉末,潮解性强,遇水发生反应如下:LiPF6+H2O![]() LiF+POF3↑+2HF↑
LiF+POF3↑+2HF↑
(1)反应Ⅰ需要控制在60℃的条件下进行,适宜的加热方式为_____________。
(2)反应Ⅰ中有一种无色无味的气体生成,该气体的电子式为_______________。反应Ⅰ的化学方程式为______________________________________。
(3)高纯LiPF6需要控制适当过量的原因可能是_____________________________。 LiPO2F2制备过程中不采用玻璃仪器的原因是____________________________。
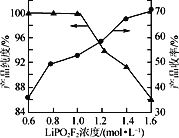
(4)保持其他实验条件都不变,在精制过程中加入提纯溶剂(杂质和LiPO2F2均可溶解在提纯溶剂中),LiPO2F2在提纯溶剂中的浓度对产品纯度和收率(收率=![]() ×100%)的影响如图所示。由图可知,随着LiPO2F2浓度的减小,产品纯度逐渐增大,收率逐渐降低。其原因可能是_______
×100%)的影响如图所示。由图可知,随着LiPO2F2浓度的减小,产品纯度逐渐增大,收率逐渐降低。其原因可能是_______
(5)已知:常温下,碳酸锂微溶于水,碳酸氢锂可溶于水。工业级碳酸锂中含有少量难溶于水且与CO2不反应的杂质。请设计从工业级碳酸锂制备高纯碳酸锂的实验方案。(实验中须使用的试剂有:去离子水,CO2气体;除常用仪器外须使用的仪器:恒温水浴锅、真空干燥箱)__________
(6)已知碳酸锂Ksp=8.6×10-4,向浓度为0.2mol·L-1的硫酸锂溶液中加入等体积的碳酸钠溶液产生沉淀,则所加碳酸钠溶液的最低浓度为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应:A(g)+B(g)2C(g)。达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化的关系分别如图一、图二所示。
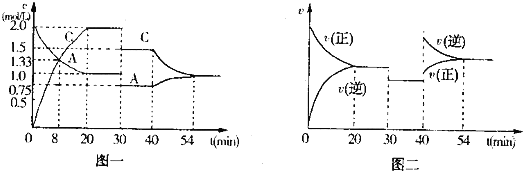
请回答下列问题:
(1)020min,A的平均反应速率为___mol/(Lmin);8min时,v(正)___v(逆)。(填“>”“=”或“<”)
(2)30min时改变的反应条件是___.
(3)40min时改变的条件是升高温度,则该反应的正反应为___(填“吸热”或“放热”)反应。
(4)能判断该反应是否达到化学平衡状态的依据是______(多项选择)。
a.容器内压强不变 b.混合气体中c(A)不变
c.v正(A)=v逆(B) d.c(A)=c(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数的值。下列说法正确的是
A.1 L0.5 mol/L Na2SO3溶液中含氧原子数为1.5NA
B.1 mol Na2O2中阴阳离子总数为3NA
C.4.6 g NO2和N2O4混合气体中含氧原子数为0.3NA
D.11.2 L NH3所含的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向500 mL稀硝酸中加入一定量的铁粉,铁粉完全溶解后,放出NO 6.272L(标准状况下),同时溶液质量增加11.2g。下列判断不正确的是
A.原HNO3溶液的物质的量浓度为2.24 mol·L-1
B.原溶液中投入铁粉的物质的量是0.2 mol
C.反应后溶液中c(Fe3+):c(Fe2+)=2:3
D.反应后的溶液还可以溶解铜粉4.48g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,在20.0mL0.10mol·L-1氯水中滴入0.10mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。己知0.10mol·L-1氨水的电离度为1.32%,下列有关叙述正确的是

A. 该滴定过程应该选择酚酞作为指示剂
B. M点对应的盐酸体积为20.0mL
C. M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. N点处的溶液中pH<12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )

A.原子半径:Z>Y>X
B.气态氢化物的热稳定性:W>R
C.WX3和水反应生成的化合物是离子化合物
D.X元素在自然界中存在同素异形现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A.实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-![]() Cl2↑+Mn2++H2O
Cl2↑+Mn2++H2O
B.向氯化铝溶液中加入过量的氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
C.醋酸洗涤铜器表面的碱式碳酸铜:Cu2(OH)2CO3+4H+=2Cu2++CO2↑+3H2O
D.向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com