

分析 (1)可用蒸馏的方法分离沸点不同但又互溶的液体混合物;用分液的方法分离互不相溶的液体混合物;用蒸馏的方法从含碘的四氯化碳溶液中分离出单质碘和回收四氯化碳;
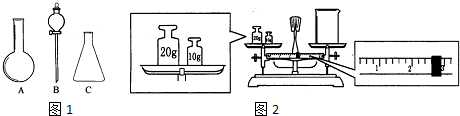
(2)称量时,应将砝码放在右盘;由图可知游码为2.6g,烧杯和游码质量之和为30g;
(3)A.胶头滴管不能伸入试管内;
B.加热固体时应防止试管炸裂;
C.气体应从长导管进入;
D.过滤时应防止滤液飞溅;
(4)如确定水层或有机层,可加入水,利用长层溶液是否分层判断.
解答 解:(1)应在圆底烧瓶中用蒸馏的方法分离沸点不同但又互溶的液体混合物;在分液漏斗中用分液的方法分离互不相溶的液体混合物;用蒸馏的方法从含碘的四氯化碳溶液中分离出单质碘和回收四氯化碳,
故答案为:A;蒸馏; B;分液;蒸馏;
(2)称量时,应将砝码放在右盘;由图可知游码为2.6g,烧杯和游码质量之和为30g,则烧杯的质量为30g-6.4g=27.4g,
故答案为:左码右物;27.4;
(3)A.胶头滴管不能伸入试管内,防止污染滴管;
B.加热固体时应防止试管炸裂,试管口应略朝上倾斜;
C.洗气时气体应从长导管进入;
D.过滤时应防止滤液飞溅,可将漏斗颈紧贴烧杯内壁,
故答案为:A 胶头滴管伸入到试管内; B试管底部略低于试管口;C混合气体沿短导气管进,长导气管出; D 漏斗颈没做到紧贴烧杯内壁;
(4)如确定水层或有机层,可加入水,利用长层溶液是否分层判断,方法是取一支小试管,打开分液漏斗的活塞,慢慢放出少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中,下层是“水层”,反之,则上层是水层,
故答案为:取一支小试管,打开分液漏斗的活塞,慢慢放出少量液体,往其中加入少量水,如果加水后,试管中的液体不分层,说明分液漏斗中,下层是“水层”,反之,则上层是水层.
点评 本题考查物质的分离提纯方法及选择,为高频考点,侧重于学生的分析能力和实验能力的考查,注意把握基本实验操作的方法和主要事项,把握物质的性质的异同,题目难度不大.


科目:高中化学 来源: 题型:选择题
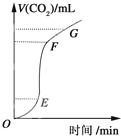
| A. | OE段表示反应速率最快 | |
| B. | EF段表示反应速率最快,收集的CO2最多 | |
| C. | FG段表示收集的CO2最多 | |
| D. | OG段表示随着时间的推移,反应速率逐渐增快 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a和b用导线连接时,该装置为原电池,铁片为负极,发生氧化反应 | |
| B. | a和b用导线连接时,Pt片上发生的反应为:Cu2++2e-═Cu | |
| C. | a和b分别连接直流电源正、负极时,该装置为电解池,Pt片为阳极,电极反应式为:4OH--4e-═O2↑+2H2O | |
| D. | a和b分别连接直流电源正、负极时,Cu2+向Pt电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4 | B. | C2H2 | C. | C3H8 | D. | C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭在氧气中剧烈燃烧,生成黑色固体 | |
| B. | 铁丝在氧气中燃烧,火星四射 | |
| C. | 红磷在空气中燃烧,产生大量的白烟 | |
| D. | 硫在空气中燃烧,生成有刺激性气味气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Cu与浓硝酸反应制 NO2:Cu+4HNO3(浓)═Cu2++2 NO3-+NO2↑+2H2O | |
| C. | 向同浓度的NaOH和Na2CO3,的混合液中加少量稀盐酸:CO32-+2H+═CO2↑+3H2O | |
| D. | 将 NaHSO4与 Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com