
【题目】在第n电子层中,当它作为原子的最外层时,其最多容纳的电子数与第(n-1)层相同;当它作为原子的次外层时,其最多容纳的电子数比(n-1)层多10个,则对此电子层的判断正确的是( )
A.必为K层B.必为L层C.必为M层D.可为任意层
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述中正确的是
4NO(g)+6H2O(g),下列叙述中正确的是
A. 达到化学平衡时4v正(O2)=5v逆(NO)
B. 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器的体积,则正反应速率减小,逆反应速率增大
D. 化学反应速率的关系是2v逆(NH3)=3v正(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
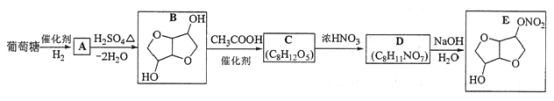
回答下列问题:
(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为______________。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式_________________________。
(2)若溶液M由10 mL 2 mol·L-1NaHA溶液与10 mL 2 mol·L-1 NaOH溶液等体积混合而成,则溶液M的pH________(填“<”“>”或“=”)7,溶液中离子浓度由大到小的顺序为______________。已知Ksp(BaA)=1.8×10-10,向该溶液中加入10 mL 1 mol·L-1BaCl2溶液,混合后溶液中的Ba2+浓度为________mol·L-1。
(3)若有下列三种溶液:①0.01 mol·L-1的H2A溶液;②0.01 mol·L-1的NaHA溶液;③0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合,则三种情况下,溶液中c(H2A)最大的是____________;pH由大到小的顺序为______________。
(4)若溶液M由pH=3的H2A溶液V1 mL与pH=11的NaOH溶液V2 mL混合反应而得,混合溶液中![]() =104,V1与V2的大小关系为________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
=104,V1与V2的大小关系为________(填“V1大于V2”“V1等于V2”“V1小于V2”或“均有可能”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下体积恒定的密闭容器中,下列叙述不是可逆反应A(气)+3B(气) ![]() 2C(气)+2D(固)达到平衡状态的标志的是( )
2C(气)+2D(固)达到平衡状态的标志的是( )
①C的生成速率与C的分解速率相等
②单位时间内生成amolA,同时生成3amolB
③A、B、C的浓度不再变化
④反应物的转化率不再变化
⑤混合气体的压强不再变化
⑥混合气体的物质的量不再变化
⑦混合气体的密度不再变化
⑧A、B、C、D的分子数之比为1:3:2:2
A. ②⑧ B. ②⑤⑧ C. ①③④⑦ D. ②⑤⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

①A为氯气发生装置。A中反应方程式是________________(锰被还原为Mn2+)。
②C中得到紫色固体和溶液。C中Cl2发生的反应有(请配平)
_____Cl2+ Fe(OH)3+ KOH![]() K2FeO4+ KCl+ H2O
K2FeO4+ KCl+ H2O
(2)探究K2FeO4的性质
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
方案Ⅰ | 取少量a,滴加KSCN溶液至过量,溶液呈红色。 |
方案Ⅱ | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b。取少量b,滴加盐酸,有Cl2产生。 |
i.由方案Ⅰ中溶液变红可知a中含有 Fe3+ 离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由________________产生(用方程式表示)。
ii.方案Ⅱ可证明K2FeO4氧化了Cl-
②根据K2FeO4的制备实验得出:氧化性Cl2________FeO42-(填“>”或“<”),而方案Ⅱ实验表明,Cl2和FeO42-的氧化性强弱关系相反,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.电解质本身不一定能导电
B.溶液中离子数目越多,导电性就越强
C.溶于水后能电离出H+的化合物都是酸
D.电解质本身必须含有阴、阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液X中含有H+、Ba2+、Al3+、NH4+、Fe3+、Fe2+、CO32-、SO32-、Cl-、SO42-、NO3-中的几种(除此以外,无其他大量存在的离子),针对该溶液进行实验,内容如下:
①用洁净的玻璃棒蘸取少量X溶液,点在PH 试纸上,试纸呈红色;
②取适量X溶液,加入过量的Ba(NO3)2溶液,得澄清透明的溶液A,并放出一种无色无味的气体B,在瓶口又慢慢变为红棕色
③向溶液A 中加入过量的NaOH 溶液,微热,放出一种刺激性气味的气体C,同时产生红褐色沉淀D,过滤得溶液F;
④向F溶液中通入过量的CO2,有白色沉淀G生成。请回答:
(1)G的化学式为:___________________________。
(2)检验气体C的方法_____________________;
(3)步骤②中反应的离子方程式为:_________________________;
(4)步骤3③中反应的离子方程式为:_______________________________;
(5)X溶液中一定含有的离子是_______________________________;在不能确定是否含有的离子中,若要确定其中一种,补做的实验是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 钠在空气中燃烧生成Na2O
B. Na2CO3比NaHCO3稳定,NaHCO3 比Na2CO3易溶于水
C. 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明该溶液中一定存在Na+,不存在K+
D. 将Na投入NH4Cl溶液中可生成两种气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com