

| A. | 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ | |
| B. | 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 | |
| C. | 通常情况下,N2(g)和O2(g)混合能直接生成NO | |
| D. | NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
分析 A.分析能量变化黑球代表氧原子,依据反应焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量计算判断;
B.依据A计算的焓变判断反应能量变化,结合反应前后能量守恒分析;
C.氮气和氧气在放电条件才能反应;
D.一氧化氮不能和氢氧化钠反应.
解答 解:A.焓变=反应物断裂化学键吸收的能量-生成物形成化学键放出的能量,N2+O2═2NO,△H=946kJ/mol+498kJ/mol-2×632kJ/mol=+180kJ/mol,反应是吸热反应,故A错误;
B.由图中数据可得反应物键的断裂吸收(946+498)=1444kJ/mol的能量,生成物键的形成放出2×632=1264 kJ/mol的能量,故该反应是吸热反应,依据能量守恒,1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,故B正确;
C.通常情况下,N2(g)和O2(g)混合不能直接生成NO,需要放电条件,故C错误;
D.一氧化氮不能和氢氧化钠反应,不是酸性氧化物,故D错误;
故选B.
点评 本题考查了反应能量变化的计算和判断,反应的焓变计算方法和能量守恒是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
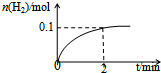 化学平衡:
化学平衡:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物A的结构简式为
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质. .
. +Br2→
+Br2→ .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 任何条件下,等物质的量的CO和NO所含的分子数一定相等 | |
| C. | 1L CO气体一定比1L O2的质量小 | |
| D. | 相同条件下的CO和N2,若体积相等,则质量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3═K++Cl5-+3O2- | B. | HNO3═H++NO3- | ||
| C. | Na2CO3═Na2++CO32- | D. | CaCl2═Ca2++Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
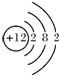 ,Cl-
,Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40g | B. | 46g | C. | 6g | D. | 33.3g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com