
A、B、C、D均为中学化学常见物质,且含有一种相同的元素,它们之间有如下转化关系,其中A是单质。
(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质。请写出C与B反应的化学方程式_________________________________。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因。请写出反应③的化学方程式____________________________________。实验室中检验气体B存在用的试剂或用品为________________。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现。据此判断A元素在周期表中的位置是_________________。请写出②的离子方程式_____________________________________________________________________________。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱。写出反应④的离子方程式
_____________________________________________________________________________________。
(1)2H2S+SO2=3S+2H2O(2分)
(2)4NH3+5O2 4NO+6H2O(2分) 湿润的红色石蕊试纸(2分)
4NO+6H2O(2分) 湿润的红色石蕊试纸(2分)
(3)第三周期第ⅢA族(2分)2Al+2OH-+6H2O=[Al(OH)4]-+3H2↑
(4)2Na2O2+2H2O=4Na++4OH-+O2↑(2分)
解析试题分析:(1)若A是一种淡黄色固体,B是气态氢化物,C、D为气态氧化物,且C是形成酸雨的主要物质,则符合条件的应该是A是S,B是H2S,C是SO2,D是SO3。H2S具有还原性,SO2具有氧化性,二者可以发生氧化还原反应生成单质硫和水,反应的化学方程式为2H2S+SO2=3S+2H2O。
(2)若B是气态氢化物,C、D为气态氧化物,且C、D是形成光化学烟雾的一个重要原因,这说明是氮元素及其化合物的转化,因此A是氮气,B是氨气,C是NO,D是NO2。氨气发生催化氧化生成NO和水,所以反应③的化学方程式为4NH3+5O2 4NO+6H2O。氨气是碱性气体能使湿润的红色石蕊试纸变蓝色,所以可以用湿润的红色石蕊试纸检验氨气。
4NO+6H2O。氨气是碱性气体能使湿润的红色石蕊试纸变蓝色,所以可以用湿润的红色石蕊试纸检验氨气。
(3)若B、D既能溶于强酸溶液,又能溶于强碱溶液,反应②③均需要强碱性溶液,反应④可以通过滴加少量稀盐酸实现,这说明该转化是铝及其化合物的转化,因此符合条件的是A是Al,B是氧化铝,C是偏铝酸钠,D是氢氧化铝。Al元素在周期表中的位置是第三周期第ⅢA族。金属铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,因此②的离子方程式为2Al+2OH-+6H2O=[Al(OH)4]-+3H2↑。
(4)若C是一种淡黄色固体,常用于吸吸面具中的供氧剂,D是一种强碱,因此C是过氧化钠,D是氢氧化钠。过氧化钠溶于水即生成氢氧化钠和氧气,所以反应④的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
考点:考查物质推断的有关判断和应用


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。常温常压下,化合物A是家庭生活中常用的一种调味品,A、C的焰色反应都呈黄色,B是无色无味的液体,D是黄绿色气体,E、F都是无色气体,F的水溶液是盐酸,H的水溶液具有漂白、杀菌性,J在水溶液中生成时为红褐色沉淀。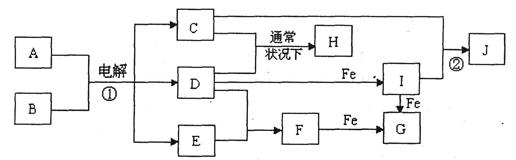
(1)H的化学式为 。
(2)F的电子式为 。
(3)反应①的化学方程式为 。
(4)反应②的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D、E、F为中学化学中的常见物质,且物质A由1~2种短周期元素组成,在一定条件下有如下转化关系,请完成下列问题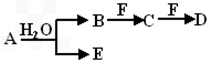
(1)若常温下A为有色气体
①若F是一种金属单质,请写出B和适量F反应生成C与气体E的离子方程式:_________________ _____________。
②若C为直线型分子,E具有漂白性,物质F焰色反应呈黄色,请写出工业上制备物质F的化学反应方程式:_______ ____________;__________ _____。
(2)若A为淡黄色固体,则A物质的电子式为:_________________。
①若物质B和D的相对分子质量相等,物质C的大量排放往往会造成严重的环境问题即_____ _____;
②若物质A和D的相对分子质量相等,请用离子方程式表示物质F的水溶液呈酸性的原因_____ _____。
(3)若物质A中一种元素原子的最外层电子数为内层电子总数的1/5,将B和D分别溶于水,所得溶液按恰当比例混合,可得一不含金属元素的盐溶液,请写出A的化学式________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1∶1。甲可作发酵粉,乙是一种常用的化肥。B、D常温下是气体。请回答下列问题:
(1)甲的俗名是____________。
(2)D的水溶液滴入酚酞试液后,溶液显红色,请用必要的文字加以解释并写出相关的离子方程式:___ _________。
(3)甲溶液中加入氯化铝溶液,可以观察到的现象为 试写出反应的离子方程式:____
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体。 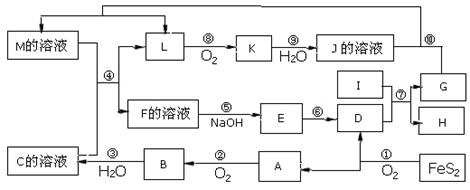
请填写下列空白:
(1)组成单质I的元素在周期表中的位置为 。
(2)欲检验F溶液中是否含有少量M,可选择的试剂为 (填化学式)。
(3)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 。
(5)将化合物D 与KNO3、KOH 共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾).同时还生成KNO2和H2O 。该反应的化学方程式是__________________________。
(6)镁与I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、I单质在一定温度下熔炼获得。
①熔炼制备镁I合金时通入氩气的目的是 。
②I电池性能优越,I-Ag2O 电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。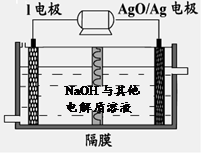
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题: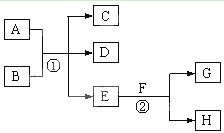
(1)在反应②中,每生成 2.24L 气体G(标准状况)时,该反应转移电子的物质的量是 mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一种使湿润红色石蕊
试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,
反应①的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在下图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,F在D中燃烧发出苍白色火焰。H可用于制造光导纤维,J是一种乳白色凝胶状沉淀。(部分生成物和部分反应条件未列出)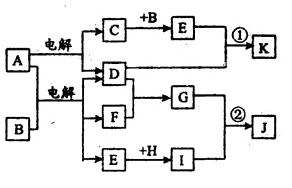
请回答下列问题:
(1)A的电子式为
形成单质D的元素在周期表中的位置
(2)形成C、D、F单质的元素半径由大到小的顺序(填写元素符号)
(3)C长期暴露在空气中,最终产物是
(4)H的化学式为 H在高温下与碳反应,若转移4mol电子参加反应的碳为 mol。
(5)写出反应①的离子方程式
(6)写出反应②的化学方程式
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分:
| 族 周期 | | | | |||||
| 1 | ① | | | | | | | |
| 2 | | | | | | ② | | |
| 3 | ③ | | | ④ | | ⑤ | ⑥ | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下表各物质中,A、B、C、D、E均含有同一种短周期元素,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。则各物质之间通过一步反应就能实现表中所示转化的是 ( )
| 物质编号 | 物质转化关系 | A | D | E |
| ① | 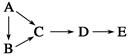 | Si | SiO2 | Na2SiO3 |
| ② | S | SO3 | H2SO4 | |
| ③ | Na | Na2O2 | NaOH | |
| ④ | N2 | NO2 | HNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com