
һ�������½�2.3 mol SO2�����1.2 mol O2�������һ�ݻ��ɱ���ܱ������У��ɻ���������λ����ͼ1��ʾ���ں��º�ѹ�·������·�Ӧ�� 2SO2��g��+ O2��g�� 2SO3��g�������С�H < 0 ������Ӧ�ﵽƽ��ʱ������λ����ͼ2��ʾ��
2SO2��g��+ O2��g�� 2SO3��g�������С�H < 0 ������Ӧ�ﵽƽ��ʱ������λ����ͼ2��ʾ��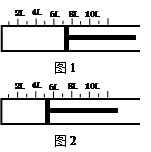
��1��ƽ��ʱSO2ת����Ϊ ����������ȷ��1%����
��2���������·�Ӧ��ƽ�ⳣ��Ϊ ��������λ��Ч���֣���
��3�������¶ȶԸ÷�Ӧ��SO2ת���ʵ�Ӱ�� ��
��1��87% ����2�� 1.11��103����3�������¶ȣ�SO2ת���ʽ���(����������Ҳ��)
����������������º�ѹʱ����������֮�ȵ������ʵ���֮�ȣ�ƽ��ʱ�������Ϊ5L�����ʵ���Ϊ2.5 mol,����ƽ������ʽ��2SO2��g��+ O2��g�� 2SO3��g��
2SO3��g��
��ʼ 2.3 1.2 0
�仯 2X X 2X
ƽ�� 2.3-2X 1.2- X 2X
2.3-2X + 1.2- X + 2X=2.5 X=1
����ƽ��ʱSO2ת����=2/2.3=0.87��ƽ�ⳣ����1.11��103�������¶�,ƽ�������ƶ�,���������ת���ʼ�С.
���㣺���黯ѧƽ�⡢ת���ʺ�ƽ�ⳣ���ļ��㡢�¶ȶ�ƽ���Ӱ�졣��


 ��ѧ����ϵ�д�
��ѧ����ϵ�д� �ο�������ϵ�д�
�ο�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���з�Ӧ��mA(g)+nB(g) pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����:
pC(g)���ﵽƽ��������¶�ʱ��B��ת���ʱ����Сѹǿʱ�������ϵ��C����������Ҳ��С����:
��1���÷�Ӧ���淴ӦΪ �ȷ�Ӧ��m+n p(�������=��������)��
��2����ѹʱ��A���������� ��(�������С�����䡱����ͬ)
��3��������B(�������)����A��ת���� ��B�ĵ�ת���� ��
��4���������¶ȣ���ƽ��ʱB��C��Ũ��֮��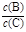 �� ��
�� ��
��5�������������ƽ��ʱ��������������ʵ��� ��
��6����B����ɫ���ʣ�A��C����ɫ�������C(�������)ʱ�������ɫ ����ά��������ѹǿ���䣬��������ʱ���������ɫ (��������dz�����䡱)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״�������ˮ������Ӧ������������Ӧ����ʽ���£�
CH3OH(g)��H2O(g)  CO2(g)��3H2(g)����H>0
CO2(g)��3H2(g)����H>0
(1)һ�������£������Ϊ2 L�ĺ����ܱ������г���1 mol CH3OH(g)��3 mol H2O(g)��20 s��û�������ѹǿ�Ƿ�Ӧǰ��1.2�������ü״���ʾ�÷�Ӧ������Ϊ________��
(2)�ж�(1)�п��淴Ӧ�ﵽƽ��״̬��������(�����)________��
��v��(CH3OH)��v��(CO2)
�ڻ��������ܶȲ���
�ۻ�������ƽ����Է�����������
��CH3OH��H2O��CO2��H2��Ũ�ȶ����ٷ����仯
(3)��ͼ��P�ǿ�����ƽ�л����Ļ������ر�K������ͬ�¶�ʱ����A�����г���1 mol CH3OH(g)��2 mol H2O(g)����B�����г���1.2 mol CH3OH(g)��2.4 mol H2O(g)���������ֱ���������Ӧ����֪��ʼʱ����A��B�������Ϊa L���Իش�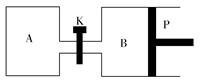
�ٷ�Ӧ�ﵽƽ��ʱ����B�����Ϊ1.5aL������B��CH3OHת����Ϊ________��A��B��������H2O(g)������ٷֺ����Ĵ�С��ϵΪ��B(�>����<������)________A��
������K��һ��ʱ������´ﵽƽ�⣬����B�����Ϊ________L(��ͨ��������������Բ��ƣ��Ҳ������¶ȵ�Ӱ��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
ij�о���ѧϰС��̽������ʵ�飺�ڳ����£�ȡ��Ƭ������ȡ����κ������ͬ�ұ��澭��ɰֽ��ĥ��ȫȥ������Ĥ����Ƭ���ֱ����ʢ����ͬ�����H��Ũ����ͬ��ϡ�����ϡ�������֧��С��ͬ���Թ��У�������Ƭ��ϡ�����в��������ķ�Ӧ���ʱ���ϡ�����еĿ졣����������Ϻ��֪����ѧ��Ӧ������Ҫ�ɲμӷ�Ӧ�����ʵ����ʾ����������������ص�Ӱ�졣
(1)д�����Ϸ�Ӧ�����ӷ���ʽ_______________________________��
(2)�������������ԭ����ܣ������SO42��������H���ķ�Ӧ���������ã������______________________________________��
(3)�����ʵ����������������֤��
��____________________________________________��
��____________________________________________��
(4)����������趼������Ҫʹ����ϡ����������Ӧ�������������ʼӿ죬���Բ�ȡ�Ĵ�ʩ�У�
��__________________________________________________��
��__________________________________________________��
��__________________________________________________��
��__________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�ô�����̼��ƺ�ϡ���ᷴӦ��ȡ������̼���壬��ش�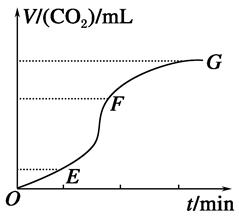
��1��ʵ�������ͼ��ʾ�������жϣ�__________�λ�ѧ��Ӧ������죬________���ռ��Ķ�����̼������ࡣ
��2��Ϊ�˼���������Ӧ�Ļ�ѧ���ʣ�������Һ�м����������ʣ�����Ϊ���е���________������ĸ��ţ���
| A������ˮ | B��NaCl���� | C��NaCl��Һ | D��Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��̼����(��Ҫָ����CO2)�ڽ������������ŷ��о�����Ҫ�����á�ĿǰNH3��(NH4)2CO3�Ѿ���������ҵ��̼����������CO2�ɷ������¿��淴Ӧ��
��Ӧ��2NH3(l)��H2O(l)��CO2(g)  (NH4)2CO3(aq)��H1
(NH4)2CO3(aq)��H1
��Ӧ��NH3(l)��H2O(l)��CO2(g)  NH4HCO3(aq)��H2
NH4HCO3(aq)��H2
��Ӧ��(NH4)2CO3(aq)��H2O(l)��CO2(g)  2NH4HCO3(aq)��H3
2NH4HCO3(aq)��H3
��ش��������⣺
��2��Ϊ�о��¶ȶ�(NH4)2CO3����CO2Ч�ʵ�Ӱ�죬��ij�¶�T1�£���һ������(NH4)2CO3��Һ�����ܱ������У�������һ������CO2����(�õ�����Ϊϡ�ͼ�)����tʱ�̣����������CO2�����Ũ�ȡ�Ȼ��ֱ����¶�ΪT2��T3��T4��T5�£�����������ʼʵ���������䣬�ظ�����ʵ�飬������ͬʱ����CO2����Ũ�ȣ��õ�����ͼ(��ͼ1)����
�٦�H3________0(�����������������)��
����T1��T2��T4��T5�����¶����䣬������CO2����Ũ�ȳ�����ͼ1��ʾ�ı仯���ƣ���ԭ����____________________________________________________________________________��
�۷�Ӧ�����¶�ΪT1ʱ����ҺpH��ʱ��仯������������ͼ2��ʾ����ʱ�䵽��t1ʱ�����÷�Ӧ��ϵ�¶�Ѹ��������T2����ά�ָ��¶ȡ����ڸ�ͼ�л���t1ʱ�̺���Һ��pH�仯���������ߡ�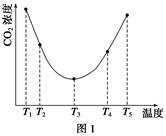

��3�����÷�Ӧ��CO2����(NH4)2CO3��ʼŨ�Ⱥ����ȷ��������£����CO2�������Ĵ�ʩ��________________________(д��2��)��
��4������������Ҳ������ΪCO2���������__________��
| A��NH4Cl | B��Na2CO3 |
| C��HOCH2CH2OH | D��HOCH2CH2NH2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��������Դ�����ϴ������ǿɳ�����չ����Ҫ���档
��1����̼��������ֱ�Ӻϳ��Ҵ�ȼ���ѽ�����ģ���������ȡ��CO��H2Ϊԭ�Ϻϳ��Ҵ�����ѧ��Ӧ����ʽ��2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)�����ܱ������г���10 mol CO��20mol H2���ڴ��������·�Ӧ�����Ҵ���CO��ת����(��)���¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
CH3CH2OH(g)+H2O(g)�����ܱ������г���10 mol CO��20mol H2���ڴ��������·�Ӧ�����Ҵ���CO��ת����(��)���¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��ʾ��
����A��B�����ʾ��ijʱ�̴ﵽ��ƽ��״̬����ʱ��A��ʱ���������Ϊ10L������¶��µ�ƽ�ⳣ����K�� ��
����A��C���㶼��ʾ�ﵽ��ƽ��״̬�����Է�Ӧ��ʼ����ƽ��״̬�����ʱ��tA tC������ڡ�����С�ڡ����ڡ�����
�۹�ҵ�ϻ����Բ�ȡ��CO2��H2Ϊԭ�Ϻϳ��Ҵ������Ҹ�����ѧ�������Ƴ磬��������ͬ�����£���CO��ȡCH3CH2OH��ƽ�ⳣ��ԶԶ������CO2��ȡCH3CH2OH��ƽ�ⳣ�������Ʋ⻯ѧ�������Ͽ���CO2��ȡCH3CH2OH���ŵ���Ҫ�ǣ� ��
��2��Ŀǰ��ҵ��Ҳ������CO2�������״���һ�������·�����ӦCO2(g)��3H2(g) CH3OH(g)��H2O(g)������6mol CO2��8 mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼ��ʾ��ʵ�ߣ���
CH3OH(g)��H2O(g)������6mol CO2��8 mol H2����2L���ܱ������У����H2�����ʵ�����ʱ��仯����������ͼ��ʾ��ʵ�ߣ���
�����ڴ����ͼ�л���״������ʵ�����ʱ��仯���ߡ�
�ڽ��ı�ijһʵ�������ٽ�������ʵ�飬���H2�����ʵ�����ʱ��仯��ͼ��������ʾ������I��Ӧ��ʵ�������ı��� �����ߢ��Ӧ��ʵ�������ı��� ��
��3��Hg��ˮ����Ⱦ���ؽ���Ԫ��֮һ��ˮ��Һ�ж��۹�����Ҫ������̬��Cl����OH����Ũ�ȹ�ϵ����ͼ��ʾ��ͼ�е����ʻ�����ֻ��Hg(OH)2Ϊ�����pCl=��1gc(Cl��)��
������˵������ȷ���� ��
A��Ϊ�˷�ֹHg2��ˮ�⣬����Hg(NO3)2��ҺʱӦ��Hg(NO3)2��������Ũ�������ϡ��
B����c(C1��) ��10��1 mol��L��1ʱ����Ԫ��һ��ȫ����HgCl42����ʽ����
C��HgCl2��һ��������ʣ�����뷽��ʽ�ǣ�HgCl2��HgCl�� + C1��
D������ҺpH������4��pCl��2�ı���6ʱ����ʹHgCl2ת��ΪHg(OH)2
��HgCl2�ֳơ����������۵�549K���������������侧���� ��������ͣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��10 L���ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g�� CO��g����H2O��g���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g����H2O��g���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
| t/�� | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�¶�ΪTʱ����2.0 L�����ܱ������г���1.0 mol PCl5����ӦPCl5(g)��PCl3(g)��Cl2(g)����һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ�IJ������ݼ��±���
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com