
ˮ��������������Ҫ���ʣ��й�ˮ�ķ�Ӧʵ���кܶࡣ
(1)�������뽫̫����ת��Ϊ���ܣ�������ˮ�������������������һ�������Դ����������ˮ�Ĺ����У�ˮ��_____________(�����������������ԭ���ȱ������ֱ���ԭ���Ȳ��������ֲ�����ԭ)
(2)ҰӪ������Я���⻯�ƹ�����Ϊ�����������ʽΪCaH2+2H2O=Ca(OH)2+2H2��,����ˮ��_____________(�����������������ԭ���ȱ������ֱ���ԭ���Ȳ��������ֲ�����ԭ)
(3)�����з�Ӧ��ˮֻ����ԭ����_____________������ţ�
| A��C+H2O=CO+H2 | B��CaO+H2O=Ca(OH)2 |
| C��3Fe+4H2O=Fe3O4+4H2 | D��3NO2+H2O=2HNO3+NO |
(1) �ȱ������ֱ���ԭ(2��) (2) ������ԭ ����2�֣�
(3) A��C ��2�֣���ѡ��1�֣�
(4)��˫���ŷ�������淴Ӧ�ĵ���ת�Ƶķ������Ŀ 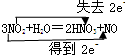
���������������1��H2O����HԪ�ػ��ϼ۽��ͣ�OԪ�ػ��ϼ����ߣ�����H2O�ȱ������ֱ���ԭ��
��2��H2Oֻ��HԪ�ػ��ϼ۽��ͣ�����H2O������ԭ��
��3��A��H2O����HԪ�ػ��ϼ۽��ͣ�����ԭ��B��H2O����Ԫ�ػ��ϼ۲��䣬�Ȳ��������ֲ�����ԭ��C��H2O����HԪ�ػ��ϼ۽��ͣ�����ԭ��D��H2O����Ԫ�ػ��ϼ۲��䣬�Ȳ��������ֲ�����ԭ��
��4��NO2��NԪ��Ϊ+4�ۣ���2��Nת��ΪHNO3�����ϼ�����Ϊ+5�ۣ�����ʧȥ2e?��1��Nת��ΪNO�����ϼ۽���Ϊ+2�ۣ��õ�2e?��Ȼ�����˫���ŷ��������ת�Ƶķ������Ŀ��
���㣺���⿼��˫���ű����ת�ơ��������ͻ�ԭ�����жϡ�


 ѧ���������ν��Ͼ���ѧ������ϵ�д�
ѧ���������ν��Ͼ���ѧ������ϵ�д� Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
Happy holiday���ּ��������ҵ�㶫���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�������ƣ�NaH2PO2�������ڻ�ѧ��������ͨ����ѧ��Ӧ�����϶Ƽ�������������Ͻ�
��1����ѧ��������Һ�к���Ni2+��H2PO2���������������·������¶�����Ӧ��
�� Ni2+ + H2PO2��+ �� Ni + H2PO3��+
�� 6H2PO2- +2H+ ��2P+4H2PO3-+3H2��
����ƽ��Ӧʽ�١�
��2����Ӧʽ���л�ԭ���� ������ԭԪ���� ��
��3����Ӧ���У�������1 mol H2PO3-����Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ ��
��4���Ӷ�����ѧ������Ӧ������������1mol Ni��1mol P��ͬʱ�� mol H2PO3�����ɡ�
��5��������и�С���еĻ�ѧ��Ӧ����ʽ���������O2��Ӧ����������ϸ��ӣ�����ͨ�������K2O�����������K2O2�����г�������ͳ�������ȡ�Ҫ�Ʊ����������ͨ������һ�����ü������ԭ��Ӧ�Ĺ�����������λ��������Ρ�д�����л�ѧ��Ӧʽ��
������������Ʒ�Ӧ
�ڼػ�ԭ����ػ�������һ�ֵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����ϡ��Ԫ�صĵ��ʺͻ�����Ӧ�ù㷺��
��1����������ͽ�̿��������¯�У�����������ȼ�գ��������з�Ӧ��
3FeS2 + 12 C + 8O2 = Fe3O4 + 12CO + 6S
����3mol��ʱ�����������������ʵ���Ϊ__ _________��
��2��������ػ�ѧʽΪ��K2S2O8��������ṹʽΪ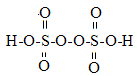
�ٹ�����غ��������ǿ�����ԣ����ȶ������ֽ⣬��2H2S2O8=2H2SO4+2SO3+O2
�����ܼӿ������ֽ�Ĺ��������� ��
| A��CuO | B��MnO2 | C��Fe2O3 | D��NaNO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
������ԭ��Ӧ�������������о��й㷺��;���ᴩ�Ž�
��1�����������������е��������з���������ԭ��Ӧ���� ������������ȷѡ�
| A���Ŵ�����ӡˢ | B��ԭ��ع��� | C����е֯�� | D���ҹ��Ŵ�ʪ����ͭ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����֪�����������������Һ�У���������ɫ���壬����Һ���Ϻ�ɫ��ȥ�� ����һ��������ԭ��Ӧ����ϵ�й���KCl��Cl2��H2SO4��H2O��KMnO4��MnSO4��K2SO4�������ʣ�
�ٸ÷�Ӧ�У����ϼ����ߵķ�Ӧ����________�����ϼ�û�з����仯�ķ�Ӧ����_______��
��д��һ�����������������ʵ�������ԭ��Ӧ����ʽ(������ƽ) ___________��
��������Ӧ�У���������________��1 mol�������ڷ�Ӧ��________(��õ�����ʧȥ��)________mol���ӡ�
������ڷ�Ӧ�����Һ�м���NaBiO3����Һ�ֱ��Ϻ�ɫ��˵��NaBiO3��һ�����ʣ�___________________________________________________________________��
��2��ij��Ӧ��ϵ�е������У�NaOH��Au2O3��Na2S4O6��Na2S2O3��Au2O��H2O��
�ٽ��������뻹ԭ���������пո��У����������ת�Ƶķ������Ŀ��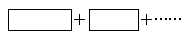
��Ӧ�У�����ԭ��Ԫ����________������������______________��
�ڷ�֯��ҵ�г���������Ư����Na2S2O3����ΪƯ�ײ�ƥ�ġ����ȼ�����Na2S2O3��Cl2��Ӧ�IJ�����H2SO4��NaCl��HCl����ԭ���������������ʵ���֮��Ϊ________��
��3��һ�������£����ˮ�м���CH3OH����HNO3��ԭ��N2�����÷�Ӧ����3.2 g CH3OHת��0.6 mol���ӣ�����������Ϊ���ѧʽ�������������뻹ԭ��������ʵ���֮����________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�⻯��ͭ��Cu2I2����һ�ֲ�����ˮҲ��������İ�ɫ���壬��;�ܹ㷺��
���������գ�
��1���⻯����Һ�еμ���������ͭ��Һ�����ܵõ��⻯��ͭ������ɲ���ƽ������Ӧ��
____KI+____CuSO4 �� ____I2+____Cu2I2��+ ____________
�÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ___________��
��2����������Ӧ����Һ�м�����ۣ���Һ�������ٵμ���������Һ����ɫ����ȥ��
д��KI��Cu2I2��H2SO3�Ļ�ԭ����ǿ������˳����____________________��
��3���⻯��ͭ�����ڼ������еĹ��������䷴ӦΪ��
2Cu2I2+Hg �� Cu2HgI4(õ���)+ 2Cu
����Cu2HgI4�У�CuԪ����____�ۡ�
����1 molCu2I2���뷴Ӧʱ��ת�Ƶ���____mol��
��4��Ϊ��ȥϡ����������CuCl2���ʣ�������Һ�м��������M�Լ�����й��˲�������ͨ��������Cl2�����N�������Լ�M�Ͳ���N�������ȷ����_____��ѡ���ţ�
| ѡ�� | �Լ�M | ����N |
| a | �⻯����Һ | ���� |
| b | �������Һ | ��ȡ��Һ |
| c | ���� | ���� |
| d | ��������Һ | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�� K2Cr2O7 +14HCl="2KCl" + 2CrCl3 + 3Cl2?+ 7H2O��Ӧ�С�
��1�� Ԫ�ر������� ����������
��2�� ��������� ����������Ӧ��
��3���ڲμӷ�Ӧ�������У���ԭ���������������õ�HCl�����������ã�δ����������HCl��������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
CuSO4��Һ��K2C2O4��Һ�������һ����ɫ����ˮ����KaCub(C2O4)c��nH2O��ͨ������ʵ��ȷ���þ������ɡ�
����a����ȡ0.6720 g��Ʒ��������ƿ����������2mol��L��1ϡ���ᣬ��ʹ��Ʒ�ܽ⡣�ټ���30 mLˮ���ȣ���0.2000mol��L��1 KMnO4��Һ�ζ����յ㣬����8.00 mL KMnO4��Һ���йط�Ӧ��2MnO4����5C2O42����16H��=2Mn2+��8H2O��10CO2��
����b�����Ž���Һ��ּ��ȡ���ȴ����pH�����������KI���壬��Һ��Ϊ��ɫ��������ɫ����CuI����0.2500mol��L��1 Na2S2O3����Һ�ζ����յ㣬����8.00 mL Na2S2O3��Һ���ζ�ʱ��ӦΪ��I2��2S2O32��=2I����S4O62��
��1������b�����ɰ�ɫ���������ӷ���ʽ�� ��
��2������b�С�����Һ��ּ��ȡ���Ŀ���� ��
��3�����������ȷ����Ʒ��ɵļ�����̡�
�ټ�����Ʒ��n (C2O42��)��д��������̣�
�ڼ�����Ʒ��n (Cu2+) ��д��������̣�
�۸��� ԭ�������n (K+)�������� ԭ�����n (H2O)
�ܸ���Ʒ����Ļ�ѧʽΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
��19��2 g ��Cu����������ϡ�����У�����Cu��ȫ��Ӧ��
��֪��3Cu + 8HNO3(ϡ) = 3Cu(NO3)2 +2NO��+ 4H2O��
��1���μӷ�Ӧ����������ʵ�����
��2������ԭ�������������
��3�����ɵ�NO�ڱ�״���µ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com