
| A. | 失电子的反应 | B. | 原电池的正极反应 | ||
| C. | 放热反应 | D. | 电镀池镀件一极的反应 |
科目:高中化学 来源: 题型:选择题
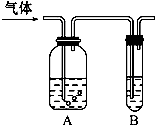 如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )
如图把气体缓慢通过盛有足量试剂的试剂瓶A,在试管B中可以观察到明显现象的是( )| 选项 | 气怵 | A中试剤 | B中试剤 |
| A | SO2、CO2 | 酸性KMnO4溶液 | 品红溶液 |
| B | Cl2、HC1 | 浓硫酸 | KI淀粉溶液 |
| C | NH3、CO2 | 浓硫酸 | 酚酞试液 |
| D | CO2、HC1 | NaOH溶液 | 澄清石灰水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NA个氧气分子和NA个氢气分子的质量比为16:1 | |
| B. | 54g H2O中含有的水分子数为3NA个 | |
| C. | 11.2L 氯气中含有的原子数为NA个 | |
| D. | 2L 1mol/L Na2SO4溶液中Na+离子数为2NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
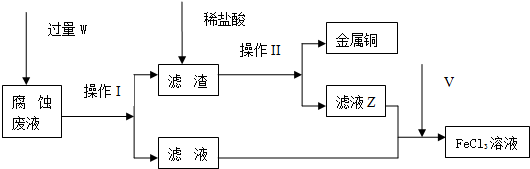
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| B. | 78 g苯含有CC双键的数目为3NA | |
| C. | 常温常压下,14 g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 (b-2a)mol•L-1 | B. | 5(b-2a)mol•L-1 | C. | 2(b-a)mol•L-1 | D. | 10(2a-b)mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

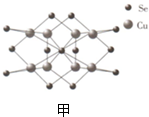

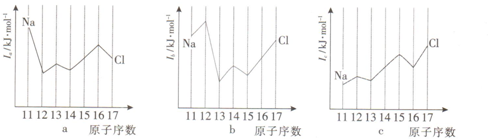
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com