
常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全反应,则下列说法错误的是
A.氨水的浓度大于盐酸的浓度
B.原氨水中有1%的含氮微粒为NH4+
C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍
D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol/L
科目:高中化学 来源: 题型:
常温时,向pH=12的Ba(OH)2溶液中加入等体积的下列溶液后,滴入酚酞试液出现红
色,该溶液应该是( )
A.pH=2的硫酸溶液 B.pH=2的醋酸溶液
C.0.05mol/L盐酸溶液 D.0.05mol/LNa2SO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
Mg、Cu和Al三种金属粉末的混合物,加入过量盐酸充分反应,过滤后向滤液中加入过量NaOH溶液,再过滤,滤液中存在的离子有( )
A.AlO2- B.Al3+ C.Mg2+ D.Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下列实验装置进行的相应实验,不能达到实验目的的是

A.图1所示装置可制取氨气
B.图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液
C.图3所示装置可制取乙烯并验证其易被氧化
D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
某兴趣小组探究以芒硝Na2SO4·10H2O和CaO为原料制备Na2CO3。
29.将CaO水化后,与芒硝形成Na2SO4-Ca(OH)2-H2O三元体系,反应后过滤,向滤液中通入CO2,期望得到Na2CO3。三元体系中反应的离子方程式为:
SO42-+ Ca(OH)2(s)+2H2O CaSO4·2H2O(s)+2 OH-
CaSO4·2H2O(s)+2 OH-
该反应的平衡常数表达式K=_________________________。
往Na2SO4-Ca(OH)2-H2O三元体系中添加适量的某种酸性物质,控制pH=12.3 [即c(OH-)=0.02mol/L],可使反应在常温下容易进行。反应后过滤,再向滤液中通入CO2,进一步处理得到Na2CO3。
30.在Na2SO4-Ca(OH)2-H2O三元体系中不直接通入CO2,其理由是_________________
______________________________________________。
31.添加的酸性物质须满足的条件(写出两点)是_____________、______________。
32.用平衡移动原理解释添加酸性物质的理由:____________________________________;
以HA表示所添加的物质,则总反应的离子方程式可写为_______________________。
33.Na2CO3溶液中存在水解平衡:CO32-+H2O HCO3-+OH-。下列说法错误的是_________。
HCO3-+OH-。下列说法错误的是_________。
a.加水稀释,溶液中所有离子的浓度都减小 b.通入CO2,溶液pH减小
c.加入NaOH固体, 减小 d.稀释溶液,平衡常数增大
减小 d.稀释溶液,平衡常数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A. 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA
B.25℃时pH=13的NaOH溶液中含有OH一的数目为0.1 NA
C.1mol的羟基与1 mol的氢氧根离子所含电子数均为9 NA
D.1.0L1.5mo1·L-1的NaAlO2水溶液中含有的氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,二者可形成
短周期元素A、B、C、D在周期表中的位置如图所示,B、D最外层电子数之和为12,二者可形成 两种分子,
两种分子, 具有漂白性。回答下列问题:
具有漂白性。回答下列问题:
(1)A的氢化物的电子式是____________。
(2)请写出能证明C、D非金属必强弱的化学方程式______。
(3)硒(Se)是人体必需的微量元素,与元素B、D同一主族,该族第2~5周期元素单质分别与 反应生成1 mol气态氢化物对应的热量变化如下,其中能表示生成1 mol硒化氢所对应的热量变化是_______(选填字母编号)。
反应生成1 mol气态氢化物对应的热量变化如下,其中能表示生成1 mol硒化氢所对应的热量变化是_______(选填字母编号)。
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8
(4) 通过下列工艺流程可制化工业原料
通过下列工艺流程可制化工业原料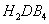 和清洁能源
和清洁能源 。
。

①为检验分离器的分离效果,取分离后的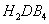 溶液于试管,向其中逐滴加入
溶液于试管,向其中逐滴加入 溶液至充分反应,若观察到________________,证明分离效果较好。
溶液至充分反应,若观察到________________,证明分离效果较好。
②在原电池中,负极发生的反应式为___________________________。
③在电解过程中,电解槽阴极附近溶液pH_______(填“变大”、“变小”或“不变”)
④将该工艺流程用反应的化学方程式表示为:________,该生产工艺的优点有________(答一点即可);缺点有___________(答一点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列比较关系与排列顺序错误的是
A.酸性 H4SiO4<H3PO4<H2SO4<HClO4 B.碱性 Ca(OH)2>Mg(OH)2>Al(OH)3
C.稳定性SiH4>NH3>H2O>HF D.半径 O2->F->Mg2+>Al3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com