
利用下列实验装置进行的相应实验,不能达到实验目的的是

A.图1所示装置可制取氨气
B.图2所示装置可分离CH3CH2OH和CH3COOC2H5混合液
C.图3所示装置可制取乙烯并验证其易被氧化
D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
下列说法正确的是( )
A.干冰升华要吸收大量的热,这就是化学反应中的吸热反应
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量
D.明矾有净水作用,所以用明矾处理硬水,可以使硬水软化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列变化可通过一步化学反应实现的是( )
A.Na2O2→Na B.Al2O3→Al(OH)3
C.SiO2→H2SiO3 D.Fe(OH)2 →Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
有关“油”的说法正确的是
A.油脂包括矿物油、植物油与动物油
B.油脂的氢化与油脂的皂化都属于加成反应
C.植物油能使碘酒褪色
D.油脂属于高分子化合物,可以发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室制备乙酸丁酯,反应温度要控制在115℃~125℃之间,其他有关数据如下表:
| 物质 | 乙酸 | 1−丁醇 | 乙酸丁酯 | 98%浓硫酸 |
| 沸点 | 117.9℃ | 117.2℃ | 126.3℃ | 338.0℃ |
| 溶解性 | 溶于水和有机溶剂 | 溶于水和有机溶剂 | 微溶于水,溶于有机溶剂 | 与水混溶 |
关于实验室制备乙酸丁酯的叙述错误的是
A.不能边反应边蒸出乙酸丁酯的原因:乙酸丁酯的沸点高
B.不用水浴加热是因为:乙酸丁酯的沸点高于100℃
C.从反应后混合物分离出粗品的方法:用Na2CO3溶液洗涤后分液
D.由粗品制精品需要进行的一步操作:加吸水剂蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全反应,则下列说法错误的是
A.氨水的浓度大于盐酸的浓度
B.原氨水中有1%的含氮微粒为NH4+
C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍
D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
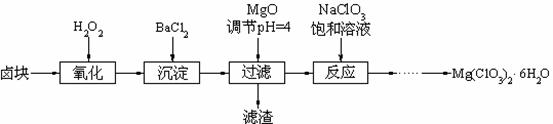
已知:
①卤块主要成分为MgCl2·6H2O,含有MgSO4、
FeCl2等杂质。
 ②几种化合物的溶解度(S)随温度(T)变化曲线
②几种化合物的溶解度(S)随温度(T)变化曲线
如右图。
40.加MgO后过滤所得滤渣的主要成分为 。
41.加入BaCl2的目的是除去SO42-,如何检验SO42-已沉淀完全? 。
42.加入NaClO3饱和溶液会发生如下反应:
MgCl2+2NaClO3 Mg(ClO3)2+2NaCl↓,
Mg(ClO3)2+2NaCl↓,
请利用该反应,结合右图,制取Mg(ClO3)2·6H2O的实验步骤依次为:
①取样,加入NaClO3饱和溶液充分反应,② ;③ ;④ ;⑤过滤、洗涤,获得Mg(ClO3)2·6H2O晶体。
产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50g产品溶解定容成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL1.000mol/L的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol/LK2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72-+6Fe2++14H+ 2Cr3++6Fe3++7H2O。
2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
43.上述产品测定中需要检查是否漏液的仪器有 。
步骤3中若滴定前不用标准液润洗滴定管,会导致最终结果偏 。(填“大”或“小”)。
44.产品中Mg(ClO3) 2·6H2O的质量分数为 。(计算结果保留两位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
发展低碳经济,构建低碳社会。科学家们提出利用以工业废气中的CO2为原料,以CuO与ZnO混合物为催化剂,其反应为:CO2 + 3H2 CH3OH + H2O。
CH3OH + H2O。
(1)某温度下,在体积为l L的密闭容器中充入lmol CO2和4mol H2,测得CO2和CH3OH(g)的浓度随时间变化如(Ⅰ)图所示。


从反应开始到平衡,甲醇的平均反应速率v(CH3OH)= ;氢气的转化率为 。
(2)常温常压下已知下列反应的能量变化如(Ⅱ)图所示:


写出由二氧化碳和氢气制备甲醇的热化学方程式: ,该反应的△S 0(填“>”或“<”或“=”);反应达到平衡后,要使该平衡向右移动,其它条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.升高温度 C.恒容条件下通入CO2 D.使用合适的催化剂
(3)在实际生产中发现,随着甲醇的生成,还伴随有少量CO等副产物出现,且CO2的转化率、甲醇和CO的含量还受气体混合物在反应锅炉内的流动速率、催化剂CuO的质量分数影响。通过实验分别得到如下图。
 ①由图(Ⅲ)得,生产甲醇的气体最佳流动速率为 L·h-1;
①由图(Ⅲ)得,生产甲醇的气体最佳流动速率为 L·h-1;
②已知当催化剂中没有CuO,只有单组份ZnO时,反应速率最大。说明为什么不选择单组份ZnO的原因 ,根据图(Ⅳ)判断,催化剂CuO的质量分数最
好为 %。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com